Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol Cl2, O2 là a, b
=> a+b = \(\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Có 71a + 32b = 19,7 - 7,8 = 11,9
=> a = 0,1 ; b = 0,15
Gọi số mol Mg, Al là x, y
=> 24x + 27y = 7,8
Mg0 - 2e --> Mg+2
x---->2x
Al0 - 3e --> Al+3
y--->3y
Cl20 +2e--> 2Cl-
0,1-->0,2
O20 +4e--> 2O-2
0,15->0,6
Bảo toàn e: 2x + 3y = 0,8
=> x = 0,1 ; y = 0,2
\(\%Al=\dfrac{0,2.27}{7,8}.100\%=69,23\%\)
=> B

Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 27y = 7,8 (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BT e, có: 2x + 3y = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{2,4}{7,8}.100\%\approx30,77\%\\\%m_{Al}\approx69,23\%\end{matrix}\right.\)
b, BTNT Mg và Al, có:
nMgCl2 = nMg = 0,1 (mol)
nAlCl3 = nAl = 0,2 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,1.95}{0,1.95+0,2.133,5}.100\%\approx26,24\%\\\%m_{AlCl_3}\approx73,76\%\end{matrix}\right.\)
Bạn tham khảo nhé!

Đáp án B
Có:
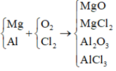
Áp dụng định luật bảo toàn khối lượng ta có:
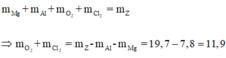
Gọi
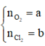
Có:
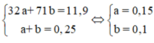
Gọi
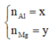
Có
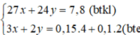
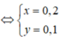
Vậy
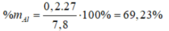

Câu 1 :
\(n_{H2}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
a 0,15 1,5a
\(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
b 0,3 1b
a) Gọi a là số mol của Al
b là số mol của Zn
\(m_{Al}+m_{Zn}=11,1\left(g\right)\)
⇒ \(n_{Al}.M_{Al}+n_{Zn}.M_{Zn}=11,1g\)
⇒ 27a + 65b = 11,1g(1)
Theo phương trình : 1,5a + 1b = 0,225(2)
Từ(1),(2), ta có hệ phương trình :
27a + 65b = 11,1g
1,5a + 1b = 0,225
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,15\end{matrix}\right.\)
\(m_{Al}=0,05.27=1,35\left(g\right)\)
\(m_{Zn}=0,15.65=9,75\left(g\right)\)
0/0Al = \(\dfrac{1,35.100}{11,1}=12,16\)0/0
0/0Zn = \(\dfrac{9,75.100}{11,1}=87,84\)0/0
b) \(n_{HCl\left(tổng\right)}=0,15+0,3=0,45\left(mol\right)\)
\(V_{ddHCl}=\dfrac{0,45}{1}=0,45\left(l\right)\)
Chúc bạn học tốt
Câu 2 :
\(n_{H2}=\dfrac{1,456}{22,4}=0,065\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
a 0,1 1a
\(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
b 0,03 1,5b
a) Gọi a là số mol của Fe
b là số mol của Al
\(m_{Fe}+m_{Al}=3,07\left(g\right)\)
⇒ \(n_{Fe}.M_{Fe}+n_{Al}.M_{Al}=3,07g\)
⇒ 56a + 27b = 3,07g(1)
Theo phương trình : 1a + 1,5b = 0,065(2)
Từ(1),(2),ta có hệ phương trình :
56a + 27b = 3,07g
1a + 1,5b = 0,065
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,01\end{matrix}\right.\)
\(m_{Fe}=0,05.56=2,8\left(g\right)\)
\(m_{Al}=0,01.27=0,27\left(g\right)\)
0/0Fe = \(\dfrac{2,8.100}{3,07}=91,21\)0/0
0/0Al = \(\dfrac{0,27.100}{3,07}=8,79\)0/0
b) \(n_{HCl\left(tổng\right)}=0,1+0,03=0,13\left(mol\right)\)
\(m_{HCl}=0,13.36,5=4,745\left(g\right)\)
\(m_{ddHCl}=\dfrac{4,745.100}{10}=47.45\left(g\right)\)
Chúc bạn học tốt

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
b, 24nMg + 27nAl = 6,12 (1)
Theo PT: \(n_{H_2}=n_{Mg}+\dfrac{3}{2}n_{Al}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,12\left(mol\right)\\n_{Al}=0,12\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,12.24}{6,12}.100\%\approx47,06\%\\\%m_{Al}\approx52,94\%\end{matrix}\right.\)

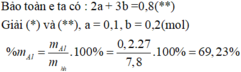

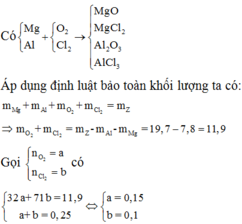
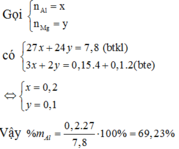
Chọn đáp án A
n H 2 = 8 , 96 22 , 4 = 0 , 4 m o l
Bảo toàn electron
3 n A l + 2 n M g = 2 n H 2 ⇒ 3 n A l + 2 n M g = 0 , 8 1 m h h = 27 n A l + 24 n M g = 7 , 8 2
Giải hệ (1) và (2)
n A l = 0 , 2 m o l , n M g = 0 , 1 m o l ⇒ % m A l = 0 , 2 . 27 7 , 8 . 100 % = 69 , 23 %