Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Ta có phương trình phản ứng:
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O
0.05 → 0 , 05 3 0,05 mol
Fe + NO3- + 4H+ → Fe3+ + NO + 2H2O
1 12 ← 0 , 1 - 0 , 05 3 → 1 12 mol
Fe + 2Fe3+ → 3 Fe2+
0 , 9 - 1 12 → 2 150
Trong dung dịch Y: n Fe 3 + = 0 , 05 + 1 12 - 2 150 = 0 , 12 mol
2Fe3+ + Cu → 2Fe2+ + Cu2+
0,12 => 0,06 mol
=> m Cu = 0 , 06 . 64 = 3 , 84 g

Đáp án C
Bản chất phản ứng của Fe, Cu với dung dịch hỗn hợp H2SO4, NaNO3 là phản ứng oxi hóa – khử. Xét toàn bộ quá trình phản ứng, ta thấy dung dịch cuối cùng chỉ chứa Na+, SO 4 2 - và NO 3 - .
Dựa vào giả thiết và áp dụng bảo toàn electron, bảo toàn điện tích cho dung dịch sau cùng, ta có :
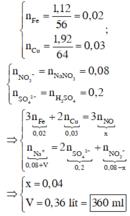

Đáp án C
Ta có 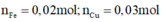
![]()
![]() e nhận
e nhận
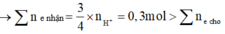
![]()
kim loại phản ứng hết
Dung dịch X chứa ![]()
![]()
Để lượng kết tủa lớn nhất gồm
![]()
![]()
![]()

Chọn đáp án C
Các chất tham gia cho biết số lượng → cần lập tỉ lệ để xác định phần đủ hay dư.
Quan sát tỉ lệ và tương quan lượng electron cho nhận 2 bên → kim loại hết, cả H+ và H + đều dư.
xác định số mol NaOH → nhớ ngay đến ý tưởng “natri đi về đâu?”
X mol Na trong NaOH thêm vào và sẵn có 0,08 mol Na đến cuối cùng sẽ đi về đâu?
→ cần tìm số mol các anion (địa chỉ của Na đi về) trong dung dịch sau phản ứng.
Xem nào, là 0,2 mol S O 4 2 - và 0,04 mol NO3- x + 0,08 = 0,2 x 2 + 0,04 → x = 0,36
Theo đó, tương ứng giá trị của V là 360 ml

Đáp án C
Ta có ![]()
![]()
![]()
![]()
![]()
kim loại phản ứng hết
Dung dịch X chứa
H
+
: ![]()
![]()
Để lượng kết tủa lớn nhất gồm ![]()
![]()
![]()

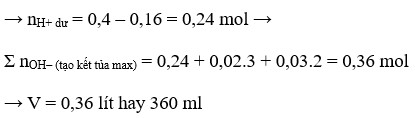
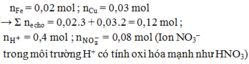
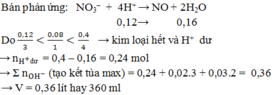

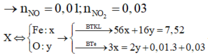
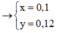
nFe = 0,13 mol; nH+ = 0,4 mol; nNO3– = 0,2 mol
4H+ + NO3– + 3e → NO + 2H2O.
⇒ H+ hết ⇒ ne = 0,3 mol ⇒ ne : nFe 2,3
⇒ X chứa Fe2+ và Fe3+ ⇒ Fe tan hết.
Bảo toàn electron cả quá trình:
2nFe + 2nCu = 0,3 ⇒ nCu = 0,02 mol
⇒ mCu = 1,28(g).
Đáp án A
A