Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1
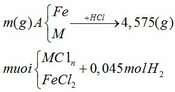
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
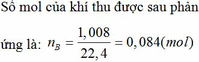
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
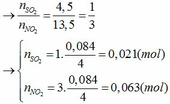
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
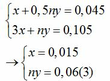
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

phần 1:
Fe[0]--->Fe[+2] + 2e
x------------------------2xmol
R[0]----->R[+n] + ne
y---------------------->yn mol
2H[+] + 2e---->H2[0] (nH2=0.095 mol)
----------0.19<----0.095mol
====> theo đl bảo toàn e: 2x + yn= 0.19 mol (1)
Phần 2:
Fe[0]---->Fe[+3] + 3e
x------------------------->3x mol
R[0]----->R[+n] + ne
y---------------------->yn mol
N[+5] + 3e---->N[+2] ( nNO= nN[+2] =0.08 mol)
-----------0.24<----0.08mol
====>theo đl bảo toàn e: 3x + yn=0.024 (2)
Lấy (2) trừ (1) ta được: x=0.05mol
**** Cả hai phần R phản ứng đều ở mức oxh [+n] nên em không cần quan tâm đến nó. Nếu đây là bài toán trắc nghiệm em có thể tính nhanh số mol Fe mỗi phần bằng cách ( khỏi phải viết mấy cái quá trình như trên dài lắm em nhá) :
n Fe = ( 3nNO) - (2nH2) =0.05 mol
Khối lượng mỗi phần = 7.22/2=3.61 g
=>m(R)= 3.61 - (0,05*56)=0.81 g
=>%mR= 0.81/3.61=22,4%
thế các số liệu vào ( phần 1)
Fe[0] -----.Fe[+2] + 2e
0.05------------------------0.1mol
R[0] -----R[+n] + ne
0.81/R--------------0.81n/R
2H[+] + 2e---->H2[0]
----------0.19<----0.095mol
Theo đl bảo toàn e: 0.1 + 0.81n/R = 0.19
=>R=9n
n=1 ==>R= 9 (l)
n=2 ==>R= 18(l)
n=3 ==>R=27( nhận)
.....
Vậy R là Al

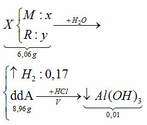
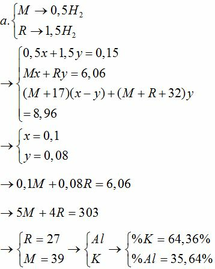
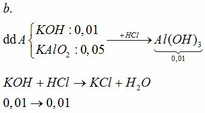
TH1: kết tủa Al(OH)3 chưa bị hòa tan
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,01 ←0,01
→ nHCl = 0,02
→ V = 0,02 (lít) = 20 (ml)
TH2: kết tủa Al(OH)3 bị hòa tan một phần
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,05 → 0,05 0,05
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,04` → 0,12
→ nHCl = 0,18 → V = 0,18 (l) = 180 (ml)
Vậy có 2 giá trị của V thỏa mãn là: 20 ml và 180 ml

a a
2M + 2nHCl -> 2MCln + nH2
b 0,5bn
P2: Fe + 4HNO3 -> Fe(NO3)3 + NO + 2H2O
a a
3M + 4nHNO3 -> 3M(NO3)n + nNO + 2nH2O
b bn/3
nH2(P1)=2,128/22,4=0,095 mol
nNO(P2)=1,792/22,4=0,08 mol
Gọi a,b là số mol Fe và M trong mỗi phần
m mỗi phần=7,22/2=3,61g
=> 56a + bM=3,61 (1)
a+0,5bn=0,095 (2)
a+bn/3=0,08 (3)
Lấy (2) - (3) ta có: 0,5bn - bn/3=0,015
=> bn=0,09 =>b=0,09/n
=>a=0,08-0,09/3=0,05 mol
=> bM=3,61 - 56.0,05=0,81 => (0,09/n) .M=0,81 => M=9n
Chạy nghiệm ta đc n=3 => M=27 (Al)
Kim loại M là Al
%mFe=0,05.2.56/7,22 .100%=77,56%
%mAl=100%-77,56%=22,44%

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ n_{Al}=x(mol);n_{Mg}=y(mol)\\ \Rightarrow 27x+24y=7,8(1)\\ a,2Al+6HCl\to 2AlCl_3+3H_2\\ Mg+2HCl\to MgCl_2+H_2\\ \Rightarrow 1,5x+y=0,4(2)\\ (1)(2)\Rightarrow x=0,2(mol);y=0,1(mol)\\ \Rightarrow \%_{Al}=\dfrac{0,2.27}{7,8}.100\%=69,23\%\\ \Rightarrow \%_{Mg}=100\%-69,23\%=30,77\%\)
\(b,\Sigma n_{HCl}=3x+2y=0,8(mol)\\ \Rightarrow C\%_{HCl}=\dfrac{0,8.36,5}{192,2}.100\%=15,19\%\\ c,n_{AlCl_3}=0,2(mol);n_{MgCl_2}=0,1(mol)\\ \Rightarrow C\%_{AlCl_3}=\dfrac{0,2.133,5}{0,2.27+192,2-0,3.2}.100\%=13,55\%\\ C\%_{MgCl_2}=\dfrac{0,1.95}{0,1.24+192,2-0,1.2}.100\%=4,89\%\)

\(n_{Mg}=x(mol);n_{Fe}=y(mol)\\ \Rightarrow 24x+56y=4(1)\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ Mg+2HCl\to MgCl_2+H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow x+y=0,1(2)\\ (1)(2)\Rightarrow x=y=0,05(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,05.56}{4}.100\%=70\%\\ \Rightarrow \%_{Mg}=100\%-70\%=30\%\)

Gọi số mol trong mỗi phần: Fe = x mol; M = y mol.
Phần 1:
Fe + 2HCl FeCl2 + H2
(mol): x x
2M + 2nHCl 2MCln + nH2
(mol): y 0,5ny
Số mol H2 = 0,07 nên x + 0,5ny = 0,07.
Phần 2:
2Fe + 6H2SO4 (đặc) Fe2(SO4)3 + 3SO2 + 6H2O
(mol): x 1,5x
2M + 2nH2SO4 (đặc) M2(SO4)n + nSO2 + 2nH2O
(mol): y 0,5nx
Số mol SO2 = 0,09 nên 1,5x + 0,5ny = 0,09. Vậy x = 0,04 và ny = 0,06.
Mặt khác: 56x + My = 2,78 nên My = 0,54. Vậy hay M = 9n.
Ta lập bảng sau:
| n | 1 | 2 | 3 |
| M | 9 ( loại ) | 18 ( loại ) | 27 ( nhận ) |
Vậy M là \(Al\) ( nhôm ) .
Đặt a là số mol Fe, b là số mol của M,trong mỗi phần,n là hóa trị của M
PTHH: Fe +2HCl ---> FeCl2 + H2
a a
2M + 2n HCl ---> 2 MCln + n H2
b bn/2
n H2= 0.07
---> a + bn/2 = 0.07 (1)
m hh A = 56a + Mb = 2.78 (2)
PTHH: Fe + 4HNO3 ----> Fe(NO3)3 + NO + 2H2O
a a
3M +4n HNO3 ---->3M(NO3)n +nNO + 2n H2O
b bn/3
n NO = a + bn/3 = 0.06 (3)
Từ (1) và (3) giải hệ ta dc : a= 0.04
bn = 0.06---> b= 0.06/n (4)
Thế à= 0.04vào pt (2) giải ra ta đc : 2.24 + Mb = 2.78
-----> b = 0.54/ M (5)
Từ (4) và (5) ----> M= 9n
Biện luận n
n=1 ----> M = 9 (loại)
n=2 ----> M= 18 (loại)
n=3-----> M=27 (nhận)
Do đó : M là Al
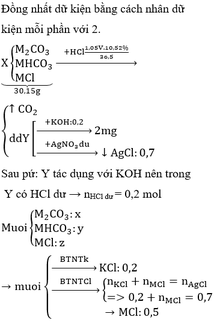
phần 1:
Fe[0]--->Fe[+2] + 2e
x------------------------2xmol
R[0]----->R[+n] + ne
y---------------------->yn mol
2H[+] + 2e---->H2[0] (nH2=0.095 mol)
----------0.19<----0.095mol
====> theo đl bảo toàn e: 2x + yn= 0.19 mol (1)
Phần 2:
Fe[0]---->Fe[+3] + 3e
x------------------------->3x mol
R[0]----->R[+n] + ne
y---------------------->yn mol
N[+5] + 3e---->N[+2] ( nNO= nN[+2] =0.08 mol)
-----------0.24<----0.08mol
====>theo đl bảo toàn e: 3x + yn=0.024 (2)
Lấy (2) trừ (1) ta được: x=0.05mol
**** Cả hai phần R phản ứng đều ở mức oxh [+n] nên em không cần quan tâm đến nó. Nếu đây là bài toán trắc nghiệm em có thể tính nhanh số mol Fe mỗi phần bằng cách ( khỏi phải viết mấy cái quá trình như trên dài lắm em nhá) :
n Fe = ( 3nNO) - (2nH2) =0.05 mol
Khối lượng mỗi phần = 7.22/2=3.61 g
=>m(R)= 3.61 - (0,05*56)=0.81 g
=>%mR= 0.81/3.61=22,4%
thế các số liệu vào ( phần 1)
Fe[0] -----.Fe[+2] + 2e
0.05------------------------0.1mol
R[0] -----R[+n] + ne
0.81/R--------------0.81n/R
2H[+] + 2e---->H2[0]
----------0.19<----0.095mol
Theo đl bảo toàn e: 0.1 + 0.81n/R = 0.19
=>R=9n
n=1 ==>R= 9 (l)
n=2 ==>R= 18(l)
n=3 ==>R=27( nhận)
.....
Vậy R là Al
cách 2 bài 1
KL M hóa trị n
Gọi x và y là số mol của Fe và KL M sau khi chia thành 2 phần và n là hóa trị của M
2x + ny = (2,128/22,4) *2
3x + ny = (1,792/22,4) *3
=>x= 0,05 ; ny = 0,09
m X =7,22/2=3,61 = 56x + My = 3,61 =>56*0,05 + My = 3,61 => My =0,81 ta có ny =0,09
lấy My/ny=0,81/0,09 <=>M/n =9
Ta có: M= 9n =>chọn M=27,n=3 .Vậy kim loại M là Al