Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C:
Gọi x, y là số mol Mg và Fe trong mỗi phần
=> 24x+56y = 4,32
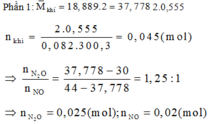

Phần 2: Gọi a, b lần lượt là số mol của AgNO3 và Cu(NO3)2
Sau phản ứng có 3 kim loại là Ag, Cu và Fe dư.
Gọi số mol Fe tham gia phản ứng là t (mol)
Bảo toàn electron ta có: nenhường= ne nhận
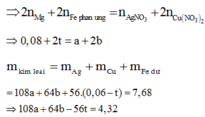
Chỉ có duy nhất Fe dư tan trong HCl
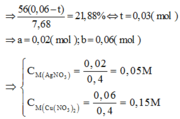

Đáp án C
nMg = 0,04. Thứ tự các phản ứng xảy ra:
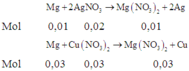
Do đó dung dịch B có chứa 0,04 mol Mg(NO3)2 và Cu(NO3)2 dư.
Khi cho NH3 dư vào B thu được kết tủa duy nhất là Mg(OH)2 (Cu(OH)2 tạo phức tan được NH3)
Đem nung kết tủa thì được chất rắn là MgO. Có nMgO = n M g ( N O 3 ) 2 = 0,04
Vậy mMgO = 1,6 (gam)

Đáp án D
Dung dịch B mất màu hoàn toàn => Cu2+ phản ứng hết
3 kim loại là Ag, Cu, Fe dư.
mFe dư =55,2-108.0,4-64.0,1=5,6 gam
Đặt số mol Mg và Fe phản ứng lần lượt là x, y
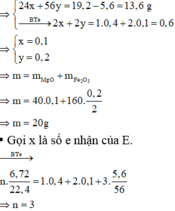
=> Khí E là NO

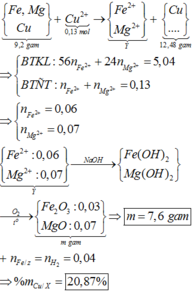


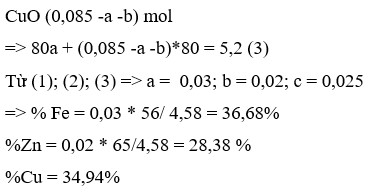
Đáp án D.
Giả sử AgNO3 phản ứng hết khi đó Ag+ chuyển hết thành Ag
nAg = = 0,4 mol à mAg = 0,4.108 = 43,2 gam > mA (=32,4 gam)
-> AgNO3 chưa phản ứng hết.
mA = mAg = 32,4 gam à nAg = 0,3 mol
Gọi số mol của Mg và Cu lần lượt là x và y mol
Theo bài ta có: 24x + 64y = 5,6 (1)
Ta có:
Mg à Mg+2 + 2e Ag + e à Ag+
x 2x 0,3 0,3
Cu à Cu+2 + 2e
y 2y
Bảo toàn e ta có: 2x + 2y = 0,3 (2)
Từ (1) và (2) ta có hệ phương trình:
Khối lượng mỗi kim loại trong hỗn hợp đầu là:
mMg = 0,1.24 = 2,4 gam; mCu = 0,05.64 = 3,2 gam.