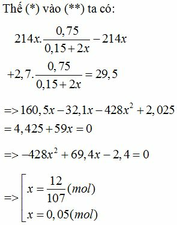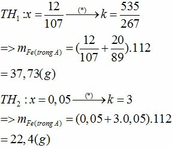Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
\(n_{Fe} = \dfrac{5,6}{56} = 0,1(mol)\\ n_S = \dfrac{2,4}{32} = 0,075(mol)\)
Fe + S \(\xrightarrow{t^o}\) FeS
0,075.......0,075,,,,,,0,075...................(mol)
nFe dư = 0,1 - 0,075 = 0,025(mol)
Fe + 2HCl → FeCl2 + H2
0,025.....0,05..........................0,025............(mol)
FeS + 2HCl → FeCl2 + H2S
0,075.........0,15...........................0,075.............(mol)
\(\Rightarrow V_{dd\ HCl} = \dfrac{0,05+0,15}{1} = 0,2(lít)\)
b) VB = (0,025 + 0,075).22,4 = 2,24(lít)

H2S:xmol;H2:ymol
ppe:x+y=0.3
nhh=x+y=0.3=>V=6.72l
34x+2y=18*(x+y)
x=0.15;y=0.15
FeS-->H2S
0.15 0.15
Fe+S-->FeS(1)
0.3 0.2 0.2
(1)=>nFeS lt=0.2
H=nFeS tt/nFeS lt *100=75%
H2S:xmol;H2:ymol
ppe:x+y=0.3
nhh=x+y=0.3=>V=6.72l
34x+2y=18*(x+y)
x=0.15;y=0.15
FeS-->H2S
0.15 0.15
Fe+S-->FeS(1)
0.3 0.2 0.2
(1)=>nFeS lt=0.2
H=nFeS tt/nFeS lt *100=75%

a/ PTHH: Fe + S ===> FeS
0,05...0,05.......0,05
FeS + 2HCl ===> FeCl2 + H2S
0,05........................................0,05
Fe + 2HCl ===> FeCl2 + H2
(0,075 - 0,05) ................................( 0,075 - 0,05) = 0,025 mol
nFe = 4,2 / 56 = 0,075 mol
nS = 1,6 / 32 = 0,05 mol
=> Fe dư, S hết
=> Chất rắn B là FeS, Fe
Hỗn hợp khí C là: H2S và H2
b/ Lập các sô mol của từng chất theo phương trình
Ta thấy: tỉ lệ về thể tích cũng là tỉ lệ về sô mol
=> %VH2S = \(\frac{0,05}{0,05+0,025}.100\%=66,67\%\)
=> %VH2 = 100% - 66,67% = 33,33%
nFe = 4.2/56=0.075(mol)
nS=1.6/32=0.05(mol)
............................. Fe + S ➞ FeS
Trước phản ứng :0.075 : 0.05 (mol)
Trong phản ứng :0.05 : 0.05 : 0.05 (mol)
Sau phản ứng :0.025 : 0 : 0.05 (mol)
Fe + 2 HCl ➞ FeCl2 + H2
0.025: :0.025 (mol).
FeS +2 HCl ➞ FeCl2 + H2S
0.05: : 0.05 (mol)
a) B là gồm (dư) , FeS
C gồm H2S , H2
b)do tỉ lệ thể tích bằng tỉ lệ số mol nên
%H2 = 0.025/(0.05+0.025)=33.333%
%H2S= 100% - 33.333% = 66.667%

2yAl +3FexOy -to-> 3xFe + yAl2O3 (1)
phần 1 : Fe +4HNO3 --> Fe(NO3)3 + NO +2H2O (2)
Al2O3 + 6HNO3 --> 2Al(NO3)3 +3H2O (3)
Al +4HNO3 --> Al(NO3)3 +NO +2H2O (4)
P2 : Al2O3 +2NaOH --> 2NaAlO2 +H2O (5)
2Al +2H2O +2NaOH --> 2NaAlO2 +3H2 (6)
vì khi cho phần 2 td vs NaOH dư thấy giải phóng H2 => Al dư sau (1)
nH2=0,015(mol)
nFe(P2)=0,045(mol)
giả sử P1 gấp k lần P2
=> nFe(P1)=0,045k(mol)
theo (5) : nAl(P2)=2/3nH2=0,01(mol)
=>nAl(P1)=0,01k(mol)
nNO=0,165(mol)
theo (2,4) :nNO=(0,045k+0,01k) (mol)
=>0,055k=0,165=> k=3
=>nAl(P1)=0,03(mol)
nFe(p1)=0,135(mol)
\(\Sigma nFe=0,045+0,135=0,18\left(mol\right)\)
\(\Sigma nAl=0,03+0,01=0,04\left(mol\right)\)
mAl2O3=\(14,49-0,135.56-0,03.27=6,12\left(g\right)\)
nAl2O3(P1)=0,06(mol)
=> nAl2O3(P2)=0,02(mol)
\(\Sigma nAl2O3=0,08\left(mol\right)\)
theo (1) : nFe=3x/ynAl2O3
=> 0,18=3x/y.0,08=> x/y=3/4
=>CTHH : Fe3O4
theo (1) :nFe3O4 =1/3nFe=0,06(mol)
=>m=0,04.27+0,06.232=15(g)
bạn Lê Đình Thái ơi bạn giải nhầm tìm m rồi. Cái 0,04 mol đó là mol dư, bạn phải cộng với 0,16 mol phản ứng khi xảy ra phản ứng nhiệt phân nữa.
Kết quả là m=0,2.27+0,06.232=19,32 gam