Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: R + 2HCl → RCl2 + H2
Mol: 0,15 0,3 0,15
\(M_R=\dfrac{8,4}{0,15}=56\left(g/mol\right)\)
⇒ R là sắt (Fe)
b, \(m_{ddHCl}=\dfrac{0,3.36,5.100}{15}=73\left(g\right)\)

a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
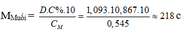
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
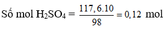
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%

a) \(n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
nHCl = 0,05.2 = 0,1
Có 2.nH2 < nHCl => R phản ứng hết
PTHH: 2R + 6HCl --> 2RCl3 + 3H2
____0,02<-----------------------0,03
=> \(M_R=\dfrac{0,54}{0,02}=27\left(Al\right)\)
b)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
___________0,06<----0,02<---0,03
=> \(\left\{{}\begin{matrix}C_{M\left(HCldư\right)}=\dfrac{0,1-0,06}{0,05}=0,8M\\C_{M\left(AlCl_3\right)}=\dfrac{0,02}{0,05}=0,4M\end{matrix}\right.\)

a,\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: x x
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: y 1,5y
Ta có: \(\left\{{}\begin{matrix}24x+27y=12,6\\x+1,5y=0,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\\y=0,2\end{matrix}\right.\)
b,\(\%m_{Mg}=\dfrac{0,3.24.100\%}{12,6}=57,14\%;\%m_{Al}=100-57,14=42,86\%\)
c,
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: 0,3 0,3 0,3
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: 0,2 0,3 0,1
\(C_{M_{ddH_2SO_4}}=\dfrac{0,3+0,3}{0,5}=1,2M\)
\(C_{M_{ddMgSO_4}}=\dfrac{0,3}{0,5}=0,6M;C_{M_{ddAl_2\left(SO_4\right)_3}}=\dfrac{0,1}{0,5}=0,2M\)