Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D
Gọi nCuO = nFe3O4 = x (mol)
=> 80x + 232x = 46,8
=> x = 0,15 (mol)
=> nCuO = nFe3O4 = 0,15 (mol)
Bảo toàn nguyên tố => Dung dịch A chứa: 0,3 mol Fe3+; 0,15 mol Fe2+; 0,15 mol Cu2+; 0,75 mol SO42-
Nhận xét: Nếu hỗn hợp (CuO, Fe3O4) => (CuO, Fe2O3) thì khối lượng tăng lên, nhưng theo bài thì 45 < 46,8. Vậy phải có một phần kim loại Mg đã bị đẩy ra.
Mg + 2Fe3+ → Mg2+ + 2Fe2+
0,15 ←0,3→ 0,15 →0,3
Mg + Cu2+ → Mg2+ + Cu
Nếu toàn bộ Cu2+ đã bị đẩy ra thì B chứa Mg2+ (0,3); Fe2+ (0,45)
=> mE = mMgO + mFe2O3 = 48 > 45 gam
Nếu Cu2+ chưa hết thì m rắn > 48 gam ( Do CuO thế chỗ MgO thì khối lượng càng tăng). Vậy phải có 1 phần Fe bị đẩy ra.
Mg + Fe2+ → Mg2+ + Fe
x → x →x → x
=> mE = 40( 0,3 + x) + 160 (0,45 – x)/ 2 = 45
=> x = 0,075
=> nMg = 0,3 + x = 0,375
=> m = 9 gam (gần nhất với 8,8 gam)

Đáp án B
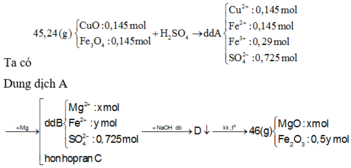
Ta có: m R a n = 46 = 40x+160.0,5y (1)
Bảo toàn điện tích ở dung dịch B: 2x+2y = 2.0,725 (2)
Giải (1) và (2) ta được: x = 0,3 mol , y = 0,425 mol
→ m = 0,3 . 24 = 7,2 (g) → giá trị gần nhất 7,4 (g)



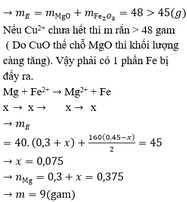






Đáp án A
Ta có số mol CuO và Fe3O4 là 0,15 mol.
Cho lượng trên tan hết trong H2SO4 thu được dung dịch A chứa CuSO4 0,15 mol, FeSO4 0,15 mol và Fe2(SO4)3 0,15 mol.
Gọi số mol của Mg là x mol.
Cho Mg vào A ta có các trường hợp sau:
+Mg chỉ tác dụng với Fe2(SO4)3 thì lúc này rắn E chứa CuO 0,15 mol, MgO x mol và Fe2O3 .
0 , 15 + 0 , 15 . 2 - 2 x 2 = 0 , 225 - x m o l → 0 , 15 . 80 + 40 x + ( 0 , 225 - x ) . 160 = 45
Giải được x>0,225 vô lý (loại).
+Mg tác dụng với CuSO4 lúc này rắn E chứa Fe2O3 0,225 mol, MgO x mol và CuO 0,3-x mol.
→ 0,225.160+40x+80(0,3-x)=45
Giải được x=0,375 >0,3 vô lý (loại).
+Mg tác dụng với FeSO4 lúc này rắn E chứa MgO x mol và Fe2O3
0 , 75 - x 2 = 0 , 375 - 0 , 5 x → 40 x + 160 ( 0 , 375 - 0 , 5 x ) = 45
Giải được x=0,375 mol → m = 9 gam.