Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2 A l + 3 H 2 S O 4 → A l 2 S O 4 3 + 3 H 2
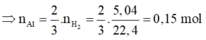
⇒ m F e 2 O 3 (bđ) = 20,05 - 0,15.27 = 16g
⇒ n F e 2 O 3 (bđ) = 16/160 = 0,1 mol
2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Bđ: 015 0,1
Pư: 0,15 0,065
Dư: 0 0,025
⇒ m F e 2 O 3 (dư) = 0,025.160=4g
⇒ Chọn A.

2Al + Fe2O3 \(\rightarrow\)Al2O3 + 2Fe (1)
Al2O3 + H2SO4 \(\rightarrow\)Al2(SO4)3 + H2O (2)
Fe + H2SO4 \(\rightarrow\)FeSO4 + H2 (3)
nH2=\(\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Theo PTHH 3 ta có:
nH2=nFe=0,225(mol)
mFe=0,225.56=12,6(g)
mAl2O3=20,05-12,6=7,45(g)
Bài làm này của em chưa đúng. Vì dựa vào các PTHH mà em viết thì em đã coi là Al phản ứng vừa đủ với Fe2O3.
Bài này có 2 trường hợp: TH1 là Al phản ứng hết, Fe2O3 còn dư.
TH2: Al dư, Fe2O3 phản ứng hết.
Em giải lại đi nhé

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g

Gọi số mol của Al và Fe lần lượt là a và b
Ta có 1,5a + b = 0,25
1,5a = 0,15
=> a = 0,1 và b = 0,1
=> %Al = 32,53%
%Fe= 67,47%

a/ PTHH: 2Al + 3H2SO4 ===> Al2(SO4)3 + 3H2
0,2 0,3 0,3
MgO + H2SO4 ===> MgSO4 + H2O
0,1 0,1
nH2 = 6,72 / 22,4 = 0,3 mol
=> nAl = 0,2 mol
=> mAl = 0,2 x 27 = 5,4 gam
=> mMgO = 9,4 - 5,4 = 4 gam
=> %mAl = \(\frac{5,4}{9,4}.100\%=57,45\%\)
%mMgO = 100% - 57,45% = 42,55%
b/ nMgO = 4 / 40 = 0,1 mol
Lập các số mol theo phương trình, ta có:
\(\sum nH2SO4\) = 0,1 + 0,3 = 0,4 mol
=> mH2SO4 = 0,4 x 96 = 38,4 gam
=> mdung dịch H2SO4 19,6% = 38,4 : 19,6% = 195,92 gam