Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Đặt công thức oxit sắt là FexOy có số mol là a mol
Ta có: nCO= 0,2 mol
FexOy+ yCO → t 0 xFe + yCO2
a ay ax ay mol
Sau phản ứng thu được ay mol CO2, (0,2-ay) mol CO dư
M ¯ = m h h n h h = 44 . a y + 28 . ( 0 , 2 - a y ) a y + 0 , 2 - a y = 40 → a y = 0 , 15 m o l T a c ó : m F e x O y = a ( 56 x + 16 y ) = 56 a x + 16 a y = 8 g a m → a x = 0 , 1 m o l → x y = a x a y = 0 , 1 0 , 15 = 2 3 → C ô n g t h ứ c o x i t l à F e 2 O 3
Sau phản ứng thu được 0,15 mol C O 2 và 0,05 mol CO dư
→ % V C O 2 = 0 , 15 0 , 2 . 100 % = 75 %

nCO = 0,25
nFe = 0,1
Hỗn hợp khí thu được gồm CO dư và CO2 có M = 18,8.2 = 37,6
Bảo toàn C ta có: n CO ban đầu = n CO dư + n CO2 = 0,25
Sử dụng sơ đồ đường chéo ⇒ n CO = 0,1 mol; n CO2 = 0,15 mol
⇒ %VCO2 =( 0,15 : 0,25). 100% = 60%
Ta có: CO + Ooxit → CO2
⇒ nO/Oxit = nCO2 = 0,15 mol
⇒nFe ÷ nO = 0,1 : 0,15 = 2: 3
⇒ Oxit đó là Fe2O3
Đáp án B.

nCO =0,2
Hỗn hợp khí thu được gồm CO dư và CO2 có M = 40
Bảo toàn C ta có: n CO ban đầu = n CO dư + n CO2 = 0,2 mol
Sử dụng sơ đồ đường chéo ta có: n CO = 0,05 mol; n CO2 = 0,15 mol
⇒ %VCO2 = 75%
Ta có: CO + Ooxit → CO2
⇒ nO/Oxit = nCO2 = 0,15 mol
moxit = mFe + mO = 8g ⇒ nFe = (8 – 0,15.16)÷56 = 0,1
⇒nFe ÷ nO/oxit = 2 : 3
⇒ Oxit đó là Fe2O3
Đáp án D.

Đặt nCO = x; nCO2 = y ⇒ nkhí = x + y = 0,5 mol || mkhí = 28x + 44y = 0,5 × 20,4 × 2.
⇒ giải hệ cho: x = 0,1 mol; y = 0,4 mol. Lại có: CO + [O] → CO2 ⇒ nO mất đi = nCO2 = 0,4 mol.
► m = mY + mO mất đi = 64 + 0,4 × 16 = 70,4(g)
Đáp án C

nCO = nCO2 = nCaCO3 = 0,04 ( bảo toàn nguyên tố C)
⇒ V= 0,896l
Đáp án B.

Đáp án A.
Lời giải
Hỗn hợp khí Y gồm 2 chất hữu cơ
=> Y gồm CH3OH và HCHO dư nhưng khi đốt cháy hết Y ta thu được sản phẩm giống hệt như khi đốt cháy hết X
Ta có: n C O 2 = 0 , 35 ( m o l ) ; n H 2 O = 0 , 65 ( m o l )
=> Trong X có: n H C H O = n C O 2 = 0 , 35 ( m o l )
Bảo toàn nguyên tố H ta có: 2 n H C H O + 2 n H 2 = 2 n H 2 O = > n H 2 = 0 , 3 ( m o l )
Vây % V H 2 = 0 , 3 0 , 65 = 46 , 15 %

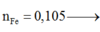
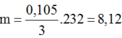

Đáp án B
Định hướng tư duy giải
Ta có: