
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

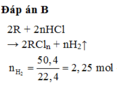
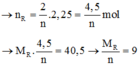
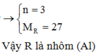

Gọi hóa trị của R là n và số mol Sn và R lần lượt là a và b mol
+/ Khi phản ứng với HCl :
Sn + HCl → SnCl2 + H2
R + nHCl → RCln + 0,5nH2
+/ Khi đốt trong oxi :
Sn + O2 → SnO2
2R + 0,5nO2 → R2On
=> Ta có : nH2 = a + 0,5nb = 0,225 mol
Và nO2 = a + 0,25nb = 0,165 mol
=> a = 0,105 mol ; nb = 0,24 mol
Có mmuối = 0,105.190 + 0,24/n . (R + 35,5n) = 36,27
=>R = 32,5n
=>Cặp n =2 ; R =65 (Zn) thỏa mãn
=>B

C
Ta có nNO = 0,15 mol.
R0 ® R+n + ne và N+5 + 3e ® N+2
x ® nx 0,45 ¬ 0,15
® x = 0,45/n ® MR = 5,4.n/0,45 = 12n
- Với n= 1 ® MR = 12 (loại)
- Với n= 2 ® MR = 24 (Mg)

Đáp án : B
Vì phản ứng các axit đồng thời => số mol HCl và H2SO4 phản ứng theo tỷ lệ mol giống như nồng độ mol ban đầu của chúng
=> nHCl : nH2SO4 = 1,5 : 0,45 = 10 : 3 = 10x : 3x
=> 2nH2 = nHCl + 2nH2SO4 => 1,2 mol = 10x + 2.3x
=> x = 0,075 mol
=> Trong muối có : 0,225 mol SO42- và 0,75 mol Cl- ; ion kim loại
( phản ứng hết axit)
=> mmuối = 11,61 + 0,225.96 + 0,75.35,5 = 59,835g