Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{20,16}{22,4}=0,9mol\)
Gọi \(\left\{{}\begin{matrix}n_{Al}=x\\n_{Mg}=y\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=27x\\m_{Mg}=24y\end{matrix}\right.\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
x \(\dfrac{3}{2}x\) ( mol )
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
y y ( mol )
Ta có:
\(\left\{{}\begin{matrix}27x+24y=19,8\\\dfrac{3}{2}x+y=0,9\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,6\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,2.27=5,4g\)
\(\Rightarrow m_{Mg}=0,6.24=14,4g\)
\(\%m_{Al}=\dfrac{5,4}{19,8}.100=27,27\%\)
\(\%m_{Mg}=100\%-27,27\%=72,73\%\)

Gọi công thức chung của 2 kim loại là R
\(HCIII\text{R + 2HCl -> RCl2 + H2}I->RCI2+H2\)
Ta có : \(nH2=0,3mol->M\text{ R}=8,8\)/\(0,3=29,3\)
Ta có : \(\text{24 < 29,3 < 40 nên 2 kim loại là Mg và Ca}\)
Gọi số mol Mg và Ca lần lượt là x , y
\(\text{-> x+y=0,3; 24x+40y=8,8}\)
Giải được \(\text{x = 0,2 ; y = 0,1 }\)
\(\text{-> mMg=24.0,2=4,8 gam -> %Mg=54,5% -> %Ca=45,5%}\)

\(n_{H2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
a 0,4 0,2 1a
\(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
b 0,3 0,15 1b
a) Gọi a là số mol của Mg
b là số mol của Fe
\(m_{Mg}+m_{Fe}=13,2\left(g\right)\)
⇒ \(n_{Mg}.M_{Mg}+n_{Fe}.M_{Fe}=13,2g\)
⇒ 24a + 56b = 13,2g (1)
Theo phương trình : 1a + 1b = 0,35(2)
Từ(1),(2), ta có hệ phương trình :
24a + 56b = 13,2g
1a + 1b = 0,35
⇒ \(\left\{{}\begin{matrix}a=0,2\\b=0,15\end{matrix}\right.\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
0/0Mg = \(\dfrac{4,8.100}{13,2}=36,36\)0/0
0/0Fe = \(\dfrac{8,4.100}{13,2}=63,64\)0/0
b) \(n_{HCl\left(tổng\right)}=0,4+0,3=0,7\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddHCl}}=\dfrac{0,7}{0,2}=3,5\left(M\right)\)
c) \(m_{muối.clorua}=\left(0,2.95\right)+\left(0,15.127\right)=38,05\left(g\right)\)
Chúc bạn học tốt

\(n_{Zn}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(n_{H_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+H_2\)
\(n_{H_2}=a+1.5b=0.4\left(mol\right)\left(1\right)\)
\(m_{Muối}=m_{ZnCl_2}+m_{AlCl_3}=136a+133.5b=40.3\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.2\)
\(m_{hh}=0.1\cdot65+0.2\cdot27=11.9\left(g\right)\)
\(\%Zn=\dfrac{0.1\cdot65}{11.9}\cdot100\%=54.62\%\)
\(\%Al=100-54.62=45.38\%\)

nH2= 0,35(mol)
a) PTHH: Mg + 2 HCl -> MgCl2 + H2
x_________2x_______x______x(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
y________2y________y_____y(mol)
Ta có hpt: \(\left\{{}\begin{matrix}24x+56y=13,2\\x+y=0,35\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
b) m=m(muối khan)= mMgCl2 + mFeCl2= 95.x+127y=95.0,2+127.0,15= 38,05(g)
a)
Gọi
\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 13,2(1)\)
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\)
Theo PTHH : \(n_{H_2} = a + b = 0,35(mol)\)(2)
Từ (1)(2) suy ra a = 0,15 ;b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,15.56}{13,2}.100\% = 63,64\%\\ \Rightarrow m_{Mg} = 100\% - 63,64\% = 36,36\%\)
b)
Ta có :\(n_{HCl} = 2n_{H_2} = 0,7(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 13,2 + 0,7.36,5 - 0,35.2=38,05(gam)\)

Sửa đề: đktc → đkc
a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: 24nMg + 56nFe = 13,2 (1)
\(n_{H_2}=\dfrac{8,6765}{24,79}=0,35\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=0,35\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,2\left(mol\right)\\n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2.24}{13,2}.100\%\approx36,36\%\\\%m_{Fe}\approx63,64\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\n_{FeCl_2}=n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
⇒ m muối khan = 0,2.95 + 0,15.127 = 38,05 (g)


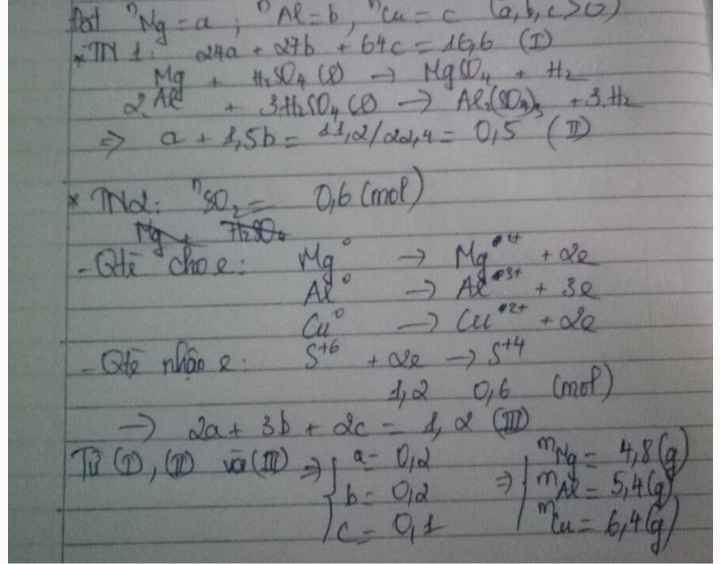
\(n_{H_2}=\dfrac{4,368}{22,4}=0,195\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: x x
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2
Mol: y 1,5y
Ta có: \(\left\{{}\begin{matrix}24x+27y=3,87\\x+1,5y=0,195\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,06\\y=0,09\end{matrix}\right.\)
\(\Rightarrow\%m_{Mg}=\dfrac{0,06.24.100\%}{3,87}=37,21\%\)
\(\%m_{Al}=100-37,21=62,79\%\)