Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\frac{3,92}{22,4}=0,175mol\)
a. PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b. Đặt \(\hept{\begin{cases}x\left(mol\right)=n_{Mg}\\y\left(mol\right)=n_{Al}\end{cases}}\)
\(\rightarrow24x+27y=3,75\left(1\right)\)
Theo phương trình \(n_{Mg}+1,5n_{Al}=n_{H_2}=0,175\)
\(\rightarrow x+1,5y=0,175\left(2\right)\)
Từ (1) và (2) \(\rightarrow\hept{\begin{cases}x=0,1mol\\y=0,05mol\end{cases}}\)
\(\rightarrow m_{Mg}=0,1.24=2,4g\)
\(\rightarrow m_{Al}=3,75-2,4=1,35g\)

a)
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
b)
Gọi $n_{Al} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b = 0,83(1)$
Theo PTHH : $n_{H_2} = 1,5a + b = \dfrac{0,56}{22,4} = 0,025(2)$
Từ (1)(2) suy ra : a = 0,01; b = 0,01
$\%m_{Al} = \dfrac{0,01.27}{0,84}.100\% = 32,1\%$
$\%m_{Fe} = 100\% - 32,1\% = 67,9\%$

a. PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
Cu + H2SO4 ---x--->
b. Theo PT: \(n_{Al}=\dfrac{2}{3}.n_{H_2}=\dfrac{2}{3}.\dfrac{6,72}{22,4}=0,2\left(mol\right)\)
=> \(m_{Al}=0,2.27=5,4\left(g\right)\)
=> \(m_{Cu}=10-5,4=4,6\left(g\right)\)
c. \(\%_{m_{Al}}=\dfrac{5,4}{10}.100\%=54\%\)
\(\%_{m_{Cu}}=100\%-54\%=46\%\)
d. Theo PT: \(n_{H_2SO_4}=n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> \(m_{H_2SO_4}=0,3.98=29,4\left(g\right)\)
Ta có: \(C_{\%_{H_2SO_4}}=\dfrac{29,4}{m_{dd_{H_2SO_4}}}.100\%=20\%\)
=> \(m_{dd_{H_2SO_4}}=147\left(g\right)\)

a) Gọi `n_{Al} = a (mol); n_{Fe} = b (mol)`
PTHH:
`2Al + 3H_2SO_4 -> Al_2(SO_4)_3 + 3H_2`
`Fe + H_2SO_4 -> FeSO_4 + H_`
b) `n_{H_2} = (0,56)/(22,4) = 0,025 (mol)`
Theo PT: `n_{H_2} = n_{Fe} + 3/2 n_{Al}`
`=> b + 1,5a = 0,025`
Giải hpt \(\left\{{}\begin{matrix}27a+56b=0,83\\1,5a+b=0,025\end{matrix}\right.\Leftrightarrow a=b=0,01\)
=> \(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,01.27}{0,83}.100\%=32,53\%\\\%m_{Fe}=100\%-32,53\%=67,47\%\end{matrix}\right.\)

Đáp án C
Gọi a, b là số mol của Al và Fe trong 8,3 g hỗn hợp ban đầu


Gọi x là số mol Al
y là số mol Mg
a) Ta có PT:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
.x..........\(\frac{3}{2}\)x...................\(\frac{1}{2}\)..............\(\frac{3}{2}\)x
Mg + H2SO4 ---> MgSO4 + H2
.y..........y..................y.............y
Theo bài ra ta có
27x + 24y = 3,75(1)
n\(H_2\) = \(\frac{3,92}{22,4}\) = 0,175(mol)
⇔ \(\frac{3}{2}\)x + y = 0,175(2)
Giải (1) và (2) ta có:
x = 0,05 ➝ mAl = 27.0,05 = 1,35(g)
y = 0,1 ➝ mMg = 24.0,1 = 2,4(g)
b)
%mAl = \(\frac{1,35}{3,75}\).100% = 36%
%mMg = 100 - 36 = 64%
c) n\(H_2SO_4\) = \(\frac{3}{2}\)x + y = 0,175 (mol)
=> V\(H_2SO_4\) = \(\frac{0,175}{1}\)= 0,175(ml)

2 A l + 3 H 2 S O 4 → A l 2 S O 4 3 + 3 H 2
x 3/2 x mol
F e + H 2 S O 4 → F e S O 4 + H 2
y y mol
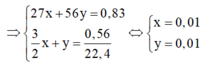
⇒ % m A l = 0,01.27 0,83 .100 = 32,53 % ⇒ % m F e = 100 % − 32,53 % = 67,47 %
⇒ Chọn D.

a, PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow27x+56y=16,6\left(1\right)\)
Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo PT: \(\Sigma n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y\left(mol\right)\)
\(\Rightarrow\dfrac{3}{2}x+y=0,05\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=\\y=\end{matrix}\right.\)
Tới đây ra số mol âm, bạn xem lại đề nhé!
a) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (1)
Mg + H2SO4 → MgSO4 + H2 (2)
b) \(n_{H_2}=\frac{3,92}{22,4}=0,175\left(mol\right)\)
Gọi x,y lần lượt là số mol của Al và Mg
Ta có: \(27x+24y=3,75\) (*)
Theo PT1: \(n_{H_2}=1,5n_{Al}=1,5x\left(mol\right)\)
Theo pT2: \(n_{H_2}=n_{Mg}=y\left(mol\right)\)
Ta có: \(1,5x+y=0,175\) (**)
Tù (*)(**) ta có: \(\left\{{}\begin{matrix}27x+24y=3,75\\1,5x+y=0,175\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
Vậy \(n_{Al}=0,05\left(mol\right)\Rightarrow m_{Al}=0,05\times27=1,35\left(g\right)\)
\(n_{Mg}=0,1\left(mol\right)\Rightarrow m_{Mg}=0,1\times24=2,4\left(g\right)\)
\(\%m_{Al}=\frac{1,35}{3,75}\times100\%=36\%\)
\(\%m_{Mg}=\frac{2,4}{3,75}\times100\%=64\%\)