Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Sửa đề: dd H2SO4 9,8%
Ta có: \(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\) \(\Rightarrow m_{H_2}=0,35\cdot2=0,7\left(g\right)\)
Bảo toàn nguyên tố: \(n_{H_2SO_4}=n_{H_2}=0,35\left(mol\right)\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,35\cdot98}{9,8\%}=350\left(g\right)\)
\(\Rightarrow m_{dd}=m_{KL}+m_{H_2SO_4}-m_{H_2}=361,6\left(g\right)\)
b) Tương tự câu a

Đáp án A
Số mol H 2 thu được là: n H 2 = 2 , 24 22 , 4 = 0 , 1 mol
Sơ đồ phản ứng hóa học:


a) Gọi số mol Al, Zn là a, b (mol)
=> 27a + 65b = 11,9 (1)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
a----->1,5a----------------->1,5a
Zn + H2SO4 --> ZnSO4 + H2
b------>b------------------>b
=> 1,5a + b = 0,4 (2)
(1)(2) => a = 0,2 (mol); b = 0,1 (mol)
\(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{11,9}.100\%=45,378\%\\\%m_{Zn}=\dfrac{0,1.65}{11,9}.100\%=54,622\%\end{matrix}\right.\)
b) nH2SO4 = 1,5a + b = 0,4 (mol)
=> mH2SO4 = 0,4.98 = 39,2 (g)
=> \(C\%_{dd.H_2SO_4}=\dfrac{39,2}{150}.100\%=26,133\%\)
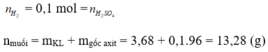
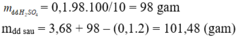
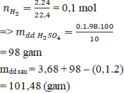

\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
\(nH_2=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn nguyên tử H:
\(nH_2SO_4=nH_2=0,1\)
\(\Rightarrow mddH_2SO_4=\dfrac{0,1.98.100}{10}=98\left(g\right)\)
\(mdd_{saupứ}=m_{kimloại}+mddH_2SO_4-mH_2=3,68+98-0,1.2=101,48\left(g\right)\)
do đó nH2SO4 = nH2 = 0,1 mol
mdd_H2SO4 = 0,1.98÷10% = 98 gam
OK bảo toàn kL:
mdd sau PƯ= mdd_H2SO4 + mhh_KL - mH2 = 98+3,68-0,1×2= 101,48