Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nMg = a ; nFe =b ; nCu = c
⇒mX =24a+ 56b + 64c =23,52 (1)
nH+ = 0,2 . 3,4 + 0,044 .5.2 = 1,12
Do lần đầu, 1 kim loại dư nên Cu sẽ dư, dung dịch Y có: Mg2+, Cu2+, Fe2+
Ở lần hai, khi thêm H2SO4, do Cu có tính khử mạnh hơn Fe2+ nên khi Cu tan hết thì Fe2+ vẫn không phản ứng nên dung dịch Y cuối cùng sẽ có: Mg2+ , Cu2+ ; Fe2+
nH+ = 8/3 nMg2+ + 8/3 nFe2+ + 8/3 nCu2+ ⇒ 8/3 a + 8/3 b + 8/3 c = 1,12 (2)
mOxit = mMgO + mFe2O3 + mCuO ⇒ 40a +80b + 80c =15,6 .2 = 31,2 (3)
Từ (1), (2), (3) ⇒ a = 0,06; b=0,12 ; c =0,24 ⇒ nFe = 0,12 mol.

Đọc quá trình, tổng hợp lại bằng sơ đồ:

Bảo toàn nguyên tố H có nH2O = 0,56 mol → ghép cụm có nNO = 0,28 mol.
Bảo toàn N có nNO3- trong X = 0,4 mol và bảo toàn S có nSO42- = 0,22 mol.
Dung dịch X có thể tích 200 mL + 44 mL = 244 mL. Công thức: CM = n ÷ V
⇒ [SO42-] = 0,22 ÷ 0,244 = 0,902M và [NO3-] = 0,4 ÷ 0,244 = 1,640M.
Đáp án B

Đáp án C
Chất rắn Y gồm 2 kim loại là Cu và Fe.
Hòa tan hết Y trong HNO3 đặc nóng thu được 0,115 mol NO2.
Gọi số mol Cu và Fe trong Y lần lượt là a, b.
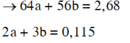
Giải được: a=0,02; b=0,025.
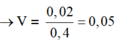
![]()
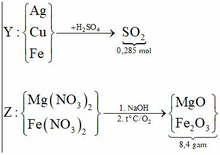
Gọi số mol Fe, Mg lần lượt là x, y
![]()
Dung dịch X chứa MgSO4 y mol và FeSO4 0,035-y mol(bảo toàn S).
Bảo toàn Fe:
![]()
Giải được: x=0,015; y=0,035.
Cho Ba(OH)2 tác dụng với X thu được kết tủa gồm BaSO4 0,035 mol và Mg(OH)20,035 mol.
Vậy nung kết tủa được rắn nặng m=9,555 gam gồm BaSO4 và MgO

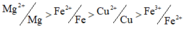
giả thiết cho Y gồm 2 kim loại thì 2 kim loại đó là Fe và Cu.

Do Y chứa Fe nên Cu2+ hết và X chứa MgSO4 và FeSO4.



⇒ kết tủa gồm 0,05 mol BaSO4; 0,025 mol Mg(OH)2; 0,024 mol Fe(OH)2
⇒ rắn khan gồm 0,05 mol BaSO4; 0,025 mol MgO; 0,0125 mol Fe2O3.
m = 0,05.233 + 0,025.40 + 0,0125.160 = 14,65gam
Đáp án B

Đáp án D
(Mg, Fe) + (AgNO3, Cu(NO3)2) => 3 kim loại
=> Chứng tỏ Mg, AgNO3, Cu(NO3)2 phản ứng hết, Fe còn dư; 3 kim loại là Ag, Cu, Fe.
Dung dịch Z chứa Mg(NO3)2 và Fe(NO3)2.
Đặt số mol Mg, Fe phản ứng, Fe dư lần lượt là a, b, c
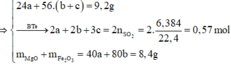
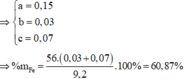

Đáp án D
Sơ đồ quá trình:
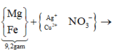
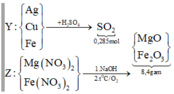
Gọi số mol Mg là x mol, Fe trong Y là y mol và Fe trong Z là z mol.
Ta có hệ phương trình:
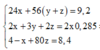
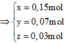
Theo đó, ![]()

Đáp án B
Giả sử KOH không dư ⇒ nKNO2 = nKOH = 0,5 mol ⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí! ⇒ KOH dư. Đặt nKNO3 = x; nKOH dư = y. Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư ⇒ 85x + 56y = 41,05 ⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
Đặt nFe = a; nCu = b ⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol. Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol. Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng: mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
-> nNO3–/X < 3nFe + 2nCu ⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%
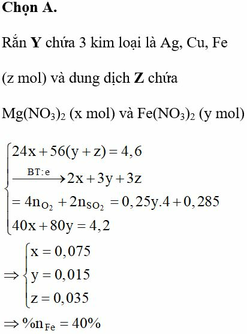
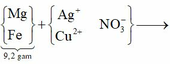

Đáp án : C