Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tách hỗn hợp trên thành Fe và O
Gọi số mol của Fe và O là x và y
nNO = 0,06 mol
bte ta có → ne nhường = 0,06.3 + 2y = 3x
btkl ta có 56x + 16y =11,36
\(\rightarrow\)nFe=0,16 mol
→ nFe(NO3)3 = 0,16 mol
→ mmuối khan = 0,16.242 = 38,72 gam → đáp án A

Quy đổi hỗn hợp ban đầu thành Fe (u) và O (v)
=> 56u + 16v = 6,72
Bảo toàn electron: 3u = 2v + 0,02.3
=>u=0,09 và v= 0,105
X hòa tan thêm Fe (0,15 mol)
Bảo toàn electron: 2nFe = nFe3+ + 3nNO.
=> nNO = 0,07
=> nHNO3 = 4nNO tổng + 2nO = 0,57
=>a = 1,14
Đáp án C

Định hướng tư duy giải
→ n NH 4 + = 0 , 235 . 2 - 0 , 14 . 3 8 = 0 , 00625
=> 110,23 = 0,73943m + 96.(0,235+0,26057m/16) => m = 38,07
=> mY = 28,15 + 62.(0,00625.8 + 0,14.3 + 0,62.2) + 80.0,00625 = 134,67

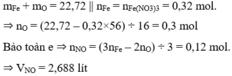
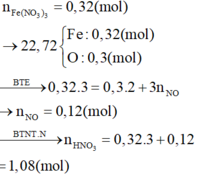
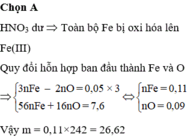

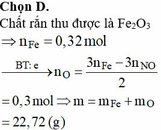
Đáp án : D
Coi hỗn hợp ban đầu gồm x mol Fe và y mol O
Muối khan chính là Fe(NO3)3 ( Vì HNO3 dư)=> nFe3+ = nFe = x = 0,32 mol
=> nO = y = 0,3 mol
Bảo toàn e : 3nNO + 2nO = 3nFe => nNO = 0,12 mol
=>VNNO = 2,688 lit