Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đổi 200ml=0,2l
\(n_{NaCl}=n_{AgCl}=0,2.1=0,2\left(mol\right)\)
\(n_{NaBr}=n_{AgBr}=0,2.1=0,2\left(mol\right)\)
\(\Rightarrow m_{kt}=m_{AgCl}+n_{AgBr}\)
\(\Rightarrow m_{kt}=0,2.143,5+0,2.188=66,3\left(g\right)\)

Đáp án A
Khi cho kẽm vào dung dịch Y, sau khi phản ứng xong thì thấy khối lượng thanh kẽm tăng nên trong Y phải có ion Ag+. Do AgNO3 dư nên đặt


Câu 1:
Gọi số mol NaCl, KCl là a, b (mol)
=> 58,5a + 74,5b = 6,81 (1)
\(n_{AgCl}=\dfrac{14,35}{143,5}=0,1\left(mol\right)\)
Bảo toàn Cl: a + b = 0,1 (2)
(1)(2) => a = 0,04 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}m_{NaCl}=0,04.58,5=2,34\left(g\right)\\m_{KCl}=0,06.74,5=4,47\left(g\right)\end{matrix}\right.\)
Câu 2:
Gọi số mol MgCl2, KCl là a, b (mol)
=> 95a + 74,5b = 3,93 (1)
25ml dd A chứa \(\left\{{}\begin{matrix}MgCl_2:0,05a\left(mol\right)\\KCl:0,05b\left(mol\right)\end{matrix}\right.\)
nAgNO3 = 0,05.0,06 = 0,003 (mol)
=> nAgCl = 0,003 (mol)
Bảo toàn Cl: 0,1a + 0,05b = 0,003 (2)
(1)(2) => a = 0,01 (mol); b = 0,04 (mol)
\(\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,01.95}{3,93}.100\%=24,173\%\\\%m_{KCl}=\dfrac{0,04.74,5}{3,93}.100\%=75,827\%\end{matrix}\right.\)

Chọn đáp án A
Kết tủa là AgCl.
n A g C l = n N a C l = 0,1.0,1 = 0,01 mol => m = 0,01.143,5 = 1,435 (gam)


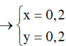
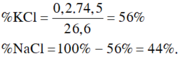
nNaCl=0,2.2=0,4(mol)
nAgNO3=0,15.2=0,3(mol)
PTHH: NaCl + AgNO3 -> AgCl (kt trắng)+ NaNO3
Ta có: 0,4/1 > 0,3/1
=> AgNO3 hết, NaCl dư, tính theo nAgNO3
=> nAgCl= nAgNO3=0,3(mol)
=> m(kết tủa)=mAgCl=0,3.143,5=43,05(g)
=> Chọn A
sao lai 0,2 *1 v b