Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

các PTHH
AlCl3+3NaOH=Al(OH)3+3NaCl (1)
x---------3x-------------x
Al(OH)3+NaOH=NaAlO2+2H2O (2)
y---------------y
kết tủa là Al(OH)3
n(ktủa)=0,2mol
nAlCl3=0,3 mol
ta nhận thấy nếu chỉ có pư 1 xảy ra thì có hai tường hợp
th1: NaOH pư vừa đủ với AlCl3 tạo ra có số mol Al(OH)3 kết tủa =số mol của AlCl3 nhưng theo đề thì kết tủa tạo ra chỉ là 0,2 mol<nAlCl3=0,3mol => trương hợp này ko có
th2: NaOH pư thiếu hay là AlCl3 còn dư khi đó số mol kết tủa tạo ra phải nhỏ hơn số mol của AlCl3=0,3mol theo đề thì số mol kết tủa là 0,2 mol<0,3mol => trường hợp này có thể có
theo pư 1 ta có
x=n(kết tủa)=0,2mol=>nNaOH=3x=0,6mol
=>VNaOH=0,6/0,5=1,2 lit (Vmin)
** còn nếu có pư 2 xảy ra tức là sau khi tạo kết tủa cực đại( n(kết tủa)=nAlCl3 )và kêt tủa bị tan lại 1 ít.
theo ptpư1 ta tính n Al(OH)3(ktủa) tạo ra cực đại
n(kết tủa max)=nAlCl3=0,3mol
=>nAl(OH)3(ktủa)bị tan=n(kết tủa max)-n(kết tủa còn lai)=0,3-0,2=0,1mol=y
từ 2ptpư ta có
nNaOH=3x+y=0,9+0,1=1mol(NaOH này là dùng cho tạo
kết tủa(pư1 3x) và tan kết tủa (pư2y)
=>VNaOH=1/0,5=2 lít (Vmax)

1) \(n_{Al\left(OH\right)_3}=\dfrac{0,78}{78}=0,01\left(mol\right)\)
PTHH: \(Al_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,03<----------------------0,01
=> nNaOH min = 0,03 (mol)
=> \(C_{M\left(NaOH\right)}=\dfrac{0,03}{0,2}=0,15M\)
2) \(n_{Al_2O_3}=\dfrac{5,1}{102}=0,05\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=0,3.0,25=0,075\left(mol\right)\)
PTHH: \(6NaOH+Al_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,45<------0,075-------------------------->0,15
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
0,05<----0,05
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
0,1<-------0,05
=> nNaOH max = 0,5 (mol)
=> \(V_{dd}=\dfrac{0,5}{2}=0,25\left(l\right)=250\left(ml\right)\)
3)
\(n_{KOH\left(1\right)}=0,15.1,2=0,18\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(1\right)}=\dfrac{4,68}{78}=0,06\left(mol\right)\)
\(n_{AlCl_3}=0,1.x\left(mol\right)\)
Do khi cho KOH tác dụng với dd Y xuất hiện kết tủa
=> Trong Y chứa AlCl3 dư
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
0,18---->0,06----------------->0,06
\(n_{KOH\left(2\right)}=0,175.1,2=0,21\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(2\right)}=\dfrac{2,34}{78}=0,03\left(mol\right)\)
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
(0,3x-0,18)<--(0,1x-0,06)------->(0,1x-0,06)
\(KOH+Al\left(OH\right)_3\rightarrow KAlO_2+2H_2O\)
(0,1x-0,09)<-(0,1x-0,09)
=> \(\left(0,3x-0,18\right)+\left(0,1x-0,09\right)=0,21\)
=> x = 1,2

Chọn D

Vì n B a C l 2 1 = 0,12 < n H 2 S O 4 1 = 0,2
Vậy H 2 S O 4 dư, B a C l 2 hết
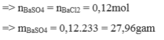

Nhận xét: nAl(OH)3 = 0,05 < nAlCl3 → kết tủa chưa đạt tối đa.
TH1: kết tủa chưa bị hòa tan
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
0,025 ← 0,05
3Ba(OH)2 + 2AlCl3 → 3BaCl2 + 2Al(OH)3↓
0,075 ← 0,05
→ nBa(OH)2 = 0,1 → V = 100 ml
TH2: kết tủa bị hòa tan một phần
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
0,025 ← 0,05
3Ba(OH)2 + 2AlCl3 → 3BaCl2 + 2Al(OH)3↓
0,15 ← 0,1 → 0,1
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
0,025 ← 0,05
Dư: 0,05
→ nBa(OH)2 = 0,2 → V = 200 ml
Vậy có 2 giá trị của V là: 100 và 200

Ta có: \(n_{HCl}=\dfrac{200}{1000}.2=0,4\left(mol\right)\)
\(PTHH:Mg+2HCl--->MgCl_2+H_2\uparrow\left(1\right)\)
a. Theo PT(1): \(n_{Mg}=n_{H_2}=n_{MgCl_2}=\dfrac{1}{2}.n_{HCl}=\dfrac{1}{2}.0,4=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,2.24=4,8\left(g\right)\\V_{H_2}=0,2.22,4=4,48\left(lít\right)\end{matrix}\right.\)
b. \(PTHH:2NaOH+MgCl_2--->Mg\left(OH\right)_2\downarrow+2NaCl\left(2\right)\)
Ta có: \(n_{NaOH}=\dfrac{\dfrac{20\%.100}{100\%}}{40}=0,5\left(mol\right)\)
Ta thấy: \(\dfrac{0,5}{2}>\dfrac{0,2}{1}\)
Vậy NaOH dư.
Theo PT(2): \(n_{Mg\left(OH\right)_2}=n_{MgCl_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Mg\left(OH\right)_2}=0,2.58=11,6\left(g\right)\)
a: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
200ml=0,2 lít
\(n_{HCl}=0.2\cdot22.4=4.48\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=2.24\left(mol\right)\)
\(\Leftrightarrow m_{H_2}=n_{H_2}\cdot M=2.24\cdot1=2.24\left(g\right)\)
\(n_{MgCl_2}=2.24\left(mol\right)\)
\(\Leftrightarrow n_{Mg}=2.24\left(mol\right)\)
\(\Leftrightarrow m_{Mg}=2.24\cdot24=53.76\left(g\right)\)

\(n_{AlCl_3}=0.2\cdot1=0.2\left(mol\right)\)
\(n_{NaOH}=0.5V\left(mol\right)\)
\(n_{Al_2O_3}=\dfrac{5.1}{102}=0.05\left(mol\right)\)
\(2Al\left(OH\right)_3\underrightarrow{^{^{t^0}}}Al_2O_3+3H_2O\)
\(0.1...............0.05\)
TH1 : Al(OH)3 không bị hòa tan.
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
\(0.1...........0.3................0.1\)
\(\Leftrightarrow V=\dfrac{0.3}{0.5}=0.6\left(l\right)\)
TH2 : Al(OH)3 bị hòa tan một phần
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
\(0.2...........0.6................0.2\)
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
\(0.5V-0.6...0.5V-0.6\)
\(n_{Al\left(OH\right)_3}=0.2+0.5V-0.6=0.1\left(mol\right)\)
\(\Rightarrow V=1\left(l\right)\)


\(n_{Al\left(OH\right)_3}=\dfrac{15,6}{78}=0,2\left(mol\right)\)
\(n_{AlCl_3}=0,2.1,5=0,3\left(mol\right)\)
PTHH: \(3NaOH+AlCl_3\rightarrow3NaCl+Al\left(OH\right)_3\)
0,9<-----0,3-------------------->0,3
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
0,1<------0,1
=> nNaOH max = 1 (mol)
=> \(V_{dd}=\dfrac{1}{0,5}=2\left(l\right)\)