
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




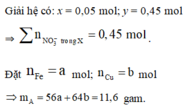
Do KOH dư ⇒ kết tủa hết ion kim loại ⇒ nung T thì rắn gồm Fe2O3 và CuO.
⇒ mrắn = 41,05 = 0,5a × 160 + 80b. Giải hệ có: a = 0,15 mol; b = 0,05 mol.
Quy hỗn hợp B về N và O. Bảo toàn nguyên tố nitơ có nN spk = 0,7 – 0,45 = 0,25 mol.

⇒ bảo toàn nguyên tố oxi có nO sk = 0,7 × 3 – 0,45 × 3 – 0,35 = 0,4 mol.
⇒ BTKL mdung dịch sau phản ứng = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2 gam.
Đáp án C

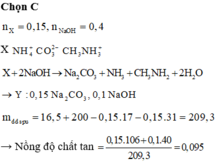
n Z = 0 , 25 m o l
CTCT của A là: C H 3 N H 3 H C O 3 = > K h í Z l à C H 3 N H 2
Do sau phản ứng chỉ thu được C H 3 N H 2 => B có CTCT là: H O C H 2 C O O N H 3 C H 3
Đặt số mol của A và B lần lượt là a, b (mol)
PTHH:
C H 3 N H 3 H C O 3 + 2 N a O H → N a 2 C O 3 + C H 3 N H 2 + 2 H 2 O
a a a
H O C H 2 C O O N H 3 C H 3 + N a O H → H O C H 2 C O O N a + C H 3 N H 2 + H 2 O
b b b b
Theo đề bài ta có hệ phương trình:
+ n Z = n C H 3 N H 2 = > a + b = 0 , 25 1
+ m c h ấ t r ắ n = m N a 2 C O 3 + m H O C H 2 C O O N a = > 106 a + 98 b = 25 , 3 ( 2 )
Giải hệ (1) và (2) được x = 0,1 và y = 0,15
=> m = 0,1.93 + 0,15.107 = 25,35 gam gần nhất với 25,6 gam
Đáp án cần chọn là: C

Đáp án A
Các phản ứng đều là kim loại đẩy kim loại ra khỏi dung dịch muối → anion → được bảo toàn.
Thứ tự các kim loại trong dãy điện hóa: Zn > Fe > Cu > Ag.
Theo đó, dung dịch cuối cùng chỉ chứa một muối duy nhất là 0,02 mol Zn(NO3)2.
ó Phản ứng: 5,2 gam Zn + ? gam Y → 0,02 mol Zn(NO3)2 + 5,82 gam chất rắn Z.
→ bảo toàn khối lượng ta cóm=4,4 gam.
ó Phản ứng: m gam (Cu, Fe) + 0,04 mol AgNO3 → 4,4 gam Y + 4,16 gam chất rắn X.
→ bảo toàn khối lượng ta có m = 4,4 + 4,16 – 0,04´170 = 1,76 gam

Đáp án B
Xét NaOH +X
tạo 0,52 mol NaCl và 0,14 mol N a 2 S O 4 và dư 0,05 mol N a +
Ghép với A l O 2 - ⇒ tạo 0,05 mol N a A l O 2
Đặt n A l = x ; n M g = y
![]()
![]()
Giải hệ có: ![]()
![]()
TH1: B a S O 4 đạt cực đại
⇒ n B a ( O H ) 2 = n S O 4 = 0 , 14 m o l
⇒ n K O H = 0 , 14 . 8 = 1 , 12 m o l
Ghép tương tự NaOH, ta thấy B a 2 + , K + , S O 4 2 - , C l - còn dư 0,6 mol điện tích
Ghép với A l O 2 - ⇒ ghép được 0,15 mol
⇒ vẫn chưa đủ ⇒ còn O H - dư
Rắn gồm 0,14 mol B a S O 4 ; 0 , 15 m o l M g O ⇒ mrắn =38,62g
TH2: A l ( O H ) 3 đạt cực đại
⇒ các ion trong dung dịch gồm B a 2 + , K + , S O 4 2 - , C l -
(ta đang giả sử B a 2 + , S O 4 2 - cùng tồn tại trong cùng 1 dung dịch)
Đặt n B a 2 + = a ⇒ n K + = 8 a
Bảo toàn điện tích:
![]()
n B a S O 4 = n B a 2 + = 0 , 08 m o l
![]()
![]()
⇒ mrắn tối đa =38,62 (g)

Đáp án B
• ![]()
• Đặt số mol Mg, Al lần lượt là a, b => 24a + 27b = 7,65 g (1)
Có n NaOH = 0 , 85 > 0 , 52 + 2 . 0 , 14 = 0 , 8
=> Chứng tỏ Al(OH)3 bị hòa tan một phần: n AlO 2 - = 0 , 85 - 0 , 8 = 0 , 05 mol
⇒ m ↓ = m Mg ( OH ) 2 + m Al ( OH ) 3 = 58 a + 78 . ( b - 0 , 05 ) = 16 , 5 g (2)
• Từ (1) và (2) suy ra a = b = 0,15
• Đặt V (lít) là thể tích dung dịch kiềm thêm vào.
⇒ n B a 2 + = 0 , 1 V , n OH - = ( 0 , 8 + 2 . 0 , 1 ) V = V
P Lượng hiđroxit thu được cực đại khi: n OH - = n H + ⇒ V = 0 , 8 ( l )
Khi đó: n B a 2 + = 0 , 08 mol < n SO 4 2 - = 0 , 14 mol
⇒ m ↓ = 58 . 0 , 15 + 78 . 0 , 15 + 233 . 0 , 08 = 39 , 04 g
P Lượng BaSO4 thu được cực đại khi: n Ba 2 + = n SO 2 - = 0 , 14 mol ⇒ n OH - = 1 , 4 mol
Khi đó: n OH - > n H + + n Al ⇒ Al ( OH ) 3 tan hết
⇒ m ↓ = 58 . 0 , 15 + 233 . 0 , 14 = 41 , 32 g > 39 , 04 g
=> Lượng kết tủa đạt cực đại khi V = 1,4 lít
⇒ m ↓ = m MgO + m B a S O 4 = 40 . 0 , 15 + 233 . 0 , 14 = 38 , 62 g
Gần nhất với giá trị 38,6