Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

R+H2SO4->R2(SO4)n+H2(1)
H2SO4+2NaOH->Na2SO4+2H2O(2)
nNaOH=0,06.0,5=0,03(mol)
->nH2SO4 dư sau phản ứng (1)=0,03/2=0,015(mol)
Mà nH2SO4 ban đầu =0,25.0,3=0.075 mol
->nH2SO4 cần cho phản ứng (1) =0,075-0,015=0,06(mol)
->nR=nH2SO4=0,06
->MR=1,44/0,06=24(Mg)

a) nH2SO4= 0,25 . 0,3 = 0,075 ( mol )
nNaOH = 0,06 . 0,5 = 0,03 ( mol )
2NaOH + H2SO4 \(\rightarrow\) Na2SO4 + 2H2O
0,03______0,015_____0,015___0,03 ( mol )
nH2SO4 ( tham gia phản ứng với kim loại ) = 0,075 - 0,015 = 0,06 (mol)
Gọi A là kim loại hoá trị II
A + H2SO4 \(\rightarrow\) ASO4 + H2
0,06__0,06____0,06___0,06 (mol)
MA = \(\dfrac{1,44}{0,06}\)= 24 ( g/mol)
Vậy A là Magie . CTHH : Mg
b) nHCl = 0,3 . 0,5 = 0,15 (mol)
nBa(OH)2 = 0,2 . a = 0,2a ( mol)
Do HCl dư nên ta sẽ kê số mol của Ba(OH)2 vào phương trình
2HCl + Ba(OH)2 \(\rightarrow\) BaCl2 + 2H2O
0,4a____0,2a_______0,2a___0,4a ( mol )
nHCl dư = 0,15 - 0,4a
CM HCl dư = \(\dfrac{0,15-0,4a}{0,5}\) = 0,02
=> 0,15 - 0,4a = 0,01
=> a = \(\dfrac{0,15-0,01}{0,4}\)= 0,35 (M)

Dưới đây là cách giải bài toán này, nhưng vì dữ kiện cho bị sai nên mình chỉ thế tạm thời hoy nha. Đây chỉ là CÁCH GIẢI và đề thì sai
-----------------------------------------
\(n_{H_2SO_4}=0,25.0,3=0,075\left(mol\right)\) (1)
\(n_{NaOH}=0,06.0,5=0,03\left(mol\right)\)
Pt: \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\) (2)
0,03mol \(\rightarrow\) 0,015mol
(1)(2) \(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,075-0,015=0,06\left(mol\right)\)
Gọi R là kim loại cần tìm
Pt: \(R+H_2SO_4\rightarrow RSO_4+H_2\)
MR 1mol
1,36g 0,06mol
\(\dfrac{M_R}{1,36}=\dfrac{1}{0,06}\)
=> MR

+ nH2SO4 = 0,075 mo ; nNaOH = 0,03 mol
-> n(kl) = 0,075 - 0,015 = 0,06 mol
-> M = 1,440,061,440,06 = 24 -> kim loại là Mg
+ nH2SO4 = 0,075 mo ; nNaOH = 0,03 mol
---> n(kl) = 0,075 - 0,015 = 0,06 mol
---> M = 1,44/0,06 = 24 ---> kim loại là Mg

nH2SO4 bđ = 0,3 . 0,25 = 0,075 mol
nNaOH = 0,5 . 0,06 = 0,03 mol
Pt: A + H2SO4 --> ASO4 + H2
....0,06<-0,06
.....2NaOH + H2SO4 --> Na2SO4 + 2H2O
....0,03 mol-> 0,015 mol
nH2SO4 còn = 0,075 - 0,015 = 0,06 mol
Ta có: 1,44 = 0,06.MA
=> MA = \(\dfrac{1,44}{0,06}=24\)
=> A là Magie (Mg)
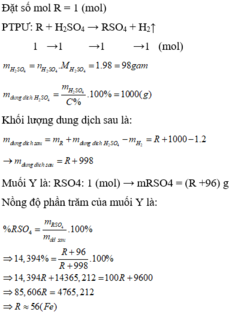
\(n_{NaOH}=0.06\cdot0.5=0.03\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=\dfrac{0.03}{2}=0.015\left(mol\right)\)
\(n_{H_2SO_4\left(pư\right)}=0.25\cdot0.3-0.015=0.06\left(mol\right)\)
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
\(0.06....0.06\)
\(M_R=\dfrac{1.44}{0.06}=24\left(\dfrac{g}{mol}\right)\)
\(R:Mg\)
n NaOH = 0,06.0,5 = 0,03(mol)
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
n H2SO4 dư = 1/2 n NaOH = 0,015(mol)
n H2SO4 pư = 0,25.0,3 - 0,015 = 0,06(mol)
$R + H_2SO_4 \to RSO_4 + H_2$
n R = n H2SO4 pư = 0,06(mol)
M R = 1,44/0,06 = 24(Mg)
Vậy R là Magie