Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt nH2SO4 = 19x và nNaNO3 = x
Khi cho dd Y tác dụng với NaOH, lọc bỏ kết tủa thì phần nước lọc chứa Na+ : x + 0,444 ( mol) và SO42- : 19x (mol)
Bảo toàn điện tích => x + 0,444 = 19x. 2
=> x = 0,012 (mol)
Trong khí Z đặt a,b,c là số mol NO, CO2, NO2
∑ nZ = a + b + c = 0,11 (1)
∑ mZ = 30a + 44b + 46c = 0,11. 2. 239/11 (2)
Bảo toàn nguyên tố N ∑ nNaNO3 = a + c = 0,012 (3) ( Vì Y + NaOH dư không tạo khí => không tạo muối amoni)
Từ (1), (2), (3) => a= 0,00525 ; b = 0,098; c = 0,00675 (mol)
Bảo toàn electron:
nFeCO3 = 3nNO + nNO2 = 0,0225 (mol)
=> % FeCO3 =[ (0,0225.116): 13,8335].100% = 18,87% ( gần nhất với 20,3%)
Đáp án C

Đáp án A
*Bài toán phụ: NaOH xử lí dung dịch sau phản ứng!
Giả sử có 19x mol H2SO4 → số mol NaNO3 là x mol.

Ø Bài này chỉ nằm ở vấn đề H+ còn dư sau phản ứng hay không? Thực sự đạt được điểm câu này hay không phụ thuộc vào “may mắn” là bạn nghĩ rồi xét trường hợp nào trước. Thật vậy???
*Khi xét trường hợp H+ còn:


Vậy đáp án nào đúng? Hay cả hai đều đúng.! Rõ là TH sau chắc chắn đúng rồi (vì giải chi tiết đến cuối).
Còn TH đầu thì sao? Nếu giải tiếp, liệu các số liệu tiếp còn ổn? vậy, cùng giải tiếp TH đầu:
Bảo toàn C có 0,08 mol MgCO 3 số mol Al2O3 còn lại 0,0344 mol (số liệu gần bằng).
Bảo toàn điện tích có số mol H + dư = 0,19x2 – 0,02x3 – 0,08x2 – 0,0344x6 – 0,01=-0,0564mol?
ồ, vậy là đến đây, số liệu đã chứng tỏ không phù hợp.! Vậy, chọn đáp án A là đáp án cuối cùng.
*Nhận xét: Một bài tập thực sự khó!

Đáp án A
![]()
Xét NaOH + Y => dung dịch cuối chứa N a 2 S O 4
![]()
Bảo toàn nguyên tố Natri: 2.19x = x + 0,37 => x = 0,01 mol
Bảo toàn nguyên tố Nitơ:
![]()
![]()
Đặt n N O = y ; n N O 2 = z => y + z = 0,01 mol;
![]()
=> giải hệ có: y = z = 0,005 mol
Đặt: ![]()
![]()
![]()
Bảo toàn nguyên tố Hidro:
![]()
Các gốc kim loại được Fe, Mg, Al được bảo toàn, tương tự với S O 4
=> bảo toàn khối lượng phần còn lại: 60a + 60b + 16.3c + 0,01.62 = 4,78 + 0,19.16
Giải hệ ta có: a = b = 0,05mol; c = 0,025 mol
![]() và hidro
và hidro

Đáp án A
![]() Xét
Xét ![]() dung dịch cuối chứa
N
a
2
S
O
4
dung dịch cuối chứa
N
a
2
S
O
4
![]() Bảo toàn nguyên tố Natri:
Bảo toàn nguyên tố Natri:
![]()
.Đặt ![]()
![]()
=>giải hệ có ![]()
![]()
![]()
![]()
Bảo toàn nguyên tố Hidro:
![]()
Các gốc kim loại ![]() được bảo toàn, tương tự với
S
O
4
và hidro
được bảo toàn, tương tự với
S
O
4
và hidro
=>bảo toàn khối lượng phần còn lại
![]()
![]()
=>Giải hệ có ![]()
![]()

Đáp án A
Xử lí cơ bản các giả thiết: X gồm 0,18 mol Zn; 0,06 mol ZnO và 0,06 mol ZnCO3.
79,22 gam kết tủa là 0,34 mol BaSO4 || 1,21 mol Na trong NaOH và ? mol trong NaNO3 cuối cùng sẽ đi về 0,34 mol Na2SO4 và 0,3 mol Na2ZnO2 → bảo toàn nguyên tố Na ta có ? mol = 0,07 mol.
Sơ đồ quá trình:

Bảo toàn điện tích trong Z có 0,01 mol NH4 → bảo toàn nguyên tố N có 0,06 mol.
« Bảo toàn O và bảo toàn H tính H2O theo hai cách khác nhau:


Đáp án A
Dễ tìm được ![]()
Bảo toàn nguyên tố Zn: ![]()
![]()
=> xét NaOH +Z: dung dịch cuối cùng chứa
Bảo toàn nguyên tố Zn: ![]()
Bảo toàn nguyên tố Na: ![]()
Bảo toàn điện tích: ![]()
![]()
Bảo toàn nguyên tố Nitơ: 0,07 = 0,01 + x + 2y
![]()
= 218/15 x 2 + (x + y + 0,06 + z)
![]()
![]()
=> 0,68 = 2 x 0,06 + 2 x 0,06 + 10x0,01 + 4x + 10y + 2z
=> giải hệ ta có:
x = z = 0,04 mol; y = 0,01 mol;
=> V = 22,4 x (0,04 + 0,01 + 0,06 + 0,04) = 33,6 lít

Đáp án A
Dễ tìm được ![]()
Bảo toàn nguyên tố Zn: ![]()
![]() xét NaOH +Z: dung dịch cuối cùng chứa
N
a
2
Z
n
O
2
v
à
N
a
2
S
O
4
xét NaOH +Z: dung dịch cuối cùng chứa
N
a
2
Z
n
O
2
v
à
N
a
2
S
O
4
Bảo toàn nguyên tố Zn: n N a 2 Z n O 2 = 0,3 mol
Bảo toàn nguyên tố Na: n N a N O 3 = n N a + / Z = 0 , 07 m o l
Bảo toàn điện tích:
n
N
H
4
+
=
0
,
1
m
o
l
![]()
Bảo toàn nguyên tố Nitơ: 0,07 = 0,01 + x + 2y
=> m T = 30x + 44y + 0,06.44 + 2z = 218/15x2 + (x+y+0,06+z)
Lại có:
n
H
+
= ![]()
=> 0,68 = 2x0,06 + 2x0,06 + 10x0,01 + 4x + 10y + 2z
=> giải hệ ta có:
x = z = 0,04 mol; y = 0,01 mol
=> V = 22,4.(0,04 + 0,01 + 0,06 + 0,04) = 33,6 lít

Đáp án A
Dễ tìm được ![]()
Bảo toàn nguyên tố ![]()
![]()
xét NaOH +Z: dung dịch cuối cùng chứa N a 2 Z n O 2 và N a 2 S O 4
Bảo toàn nguyên tố ![]()
Bảo toàn nguyên tố ![]()
Bảo toàn điện tích: ![]()
![]()
Bảo toàn nguyên tố Nitơ:
![]()
![]()
![]()
Lại có:
![]()
![]()
![]()
![]()
=> giải hệ có:
![]()
![]()

Đáp án D
Gọi số mol của Zn, ZnO, ZnCO3 lần lượt là 3x, x, x (mol)
=> 3x. 65 + 81x + 125x = 24, 06
=> x = 0,06 (mol)
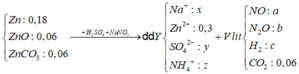
Dd Y + BaCl2 → BaSO4 : 0,34 (mol) => nSO42- =0,34 (mol) = y
Dd Y + NaOH → nOH- max = nOH- + 4 nZn2+ = 1,21 (mol)
=> nNH4+ = 1,21 – 4. 0,3 = 0,01 (mol) = z
Bảo tòan điện tích cho dd Y: ∑ n. điện tích (+) = ∑ n. điện tích (-)
=> nNa+ + 0,3. 2 + 0,01.1 = 0,34.2
=> nNa+ = 0,07 (mol) = x
BTNT N: a + 2b + 0,01 = 0,07 (1)
mT = 30a + 44b + 2c + 44.0,06 = ( a+b + c + 0,06). 436/15 (2)
Hỗn hợp ban đầu quy đổi thành Zn: 0,3 mol; O: 0,12 mol và CO2: 0,06 mol
NO3 - + 4H+ + 3e → NO + 2H2O
2NO3 - + 10H+ + 8e → N2O + 5H2O
2H+ + 2e → H2
∑n H+ = 2n H2SO4 = 4nNO + 10nN2O + 2nH2 = 4a + 10b + 2c = 0,34.2 (3)
Giải hệ (1), (2), (3) được
a = 0,04
b = 0,01
c = 0,04
=> V = (0,04+ 0,01 + 0,04+ 0,06). 22,4 = 3,36 lít gần với 3 nhất
Đáp án C
Đặt nH2SO4 = 19x và nNaNO3 = x
Khi cho dd Y tác dụng với NaOH, lọc bỏ kết tủa thì phần nước lọc chứa Na+ : x + 0,444 ( mol) và SO42- : 19x (mol)
Bảo toàn điện tích => x + 0,444 = 19x. 2
=> x = 0,012 (mol)
Trong khí Z đặt a,b,c là số mol NO, CO2, NO2
∑ nZ = a + b + c = 0,11 (1)
∑ mZ = 30a + 44b + 46c = 0,11. 2. 239/11 (2)
Bảo toàn nguyên tố N ∑ nNaNO3 = a + c = 0,012 (3) ( Vì Y + NaOH dư không tạo khí => không tạo muối amoni)
Từ (1), (2), (3) => a= 0,00525 ; b = 0,098; c = 0,00675 (mol)
Bảo toàn electron:
nFeCO3 = 3nNO + nNO2 = 0,0225 (mol)
=> % FeCO3 =[ (0,0225.116): 13,8335].100% = 18,87% ( gần nhất với 20,3%)