Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Gọi số mol các kim loại là Al: a mol; Fe: b mol.
Ta có:
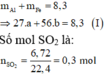
Sơ đồ phản ứng:
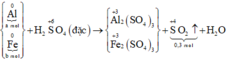
Các quá trình nhường, nhận electron:


Ta có: \(m_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\) \(\Rightarrow m_{H_2}=0,2\cdot2=0,4\left(g\right)\)
\(\Rightarrow m_{dd\left(sau.pư\right)}=m_{hh}+m_{ddH_2SO_4}-m_{H_2}=309,6\left(g\right)\)
\(\Rightarrow a=309,6-300=9,6\left(g\right)\)

Đáp án D.
nSO2 = 0,55 => ne = 0,55.2 = 1,1 (mol)
mmuối = mKL + Mgốc axit. ne/2
= 14,6 + 96. 1,1/2 = 67,4 g

Chọn A
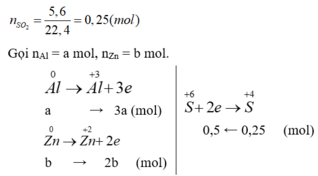
Ta có: m h h = 9 , 2 g → 27a + 65b = 9,2 (*)
Bảo toàn số mol electron có: 3a + 2b = 0,5 (**)
Giải (*), (**): a = b = 0,1 mol.
m A l = 0 , 1 . 27 = 2 , 7 g a m

Đáp án A.
Gọi nAl = a mol, nZn = b mol.

Ta có: 27a + 65b = 9,2 (*)
3a + 2b = 0,5 (**)
Giải (*), (**): a = b = 0,1 mol.
mAl = 0,1.27 = 2,7 gam

1) Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow64a+56b=18,4\) (1)
Ta có: \(n_{SO_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,35\cdot2=0,7\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,2\cdot64}{18,4}\cdot100\%\approx69,57\%\\\%m_{Fe}=30,43\%\end{matrix}\right.\)
2) PTHH: \(NaOH+SO_2\rightarrow NaHSO_3\)
Theo PTHH: \(n_{NaOH}=n_{SO_2}=0,35\left(mol\right)\) \(\Rightarrow V_{NaOH}=\dfrac{0,35}{2}=0,175\left(l\right)=175\left(ml\right)\)

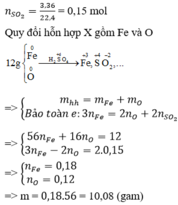

Đáp án A
Số mol SO2 thu được là: n SO 2 = 5 , 6 22 , 4 = 0 , 25 mol