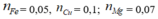Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
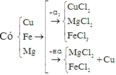
Theo định luật bảo toàn khối lượng ta có:
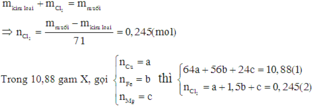
Khi cho (a + b + c) mol X tác dụng với dung dịch HCl dư thì thu được (b + c) mol H2.
Khi cho 0,44 mol X tác dụng với dung dịch HCl dư thì thu được 0,24 mol H2.
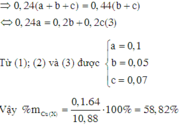

Đáp án B
Trong 10,88g X gọi số mol Cu, Fe và Mg là x, y, z
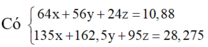
Trong 0,44 mol X có kx mol Cu, ky mol Fe và kz mol Mg (giữ đúng tỉ lệ)
Do đó kx + ky + kz = 0,44 (1)
Khi cho X tác dụng với HC1 thì
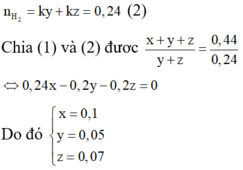
Vậy phần trăm khối lượng của Cu trong X là 58,82%

Đáp án B
Chất rắn m1 là Cu. Bảo toàn e có 2nCu=3nNO
→ 2b = 2V/70
Gọi số mol: Mg là x; Cu là y; Al là z và NH4NO3 là t
Ta có hệ phương trình
(1) 2x +3y = 2n(H2) = 0,88
(2) 24x + 64y + 27z = 19,92
(3) 148x + 188y + 213z + 80t = 97,95
(4) 2x + 2y + 3t = 3n(NO) + 8n(NH4NO3) = 3V/22,4 + 8t = 6,25y + 8t
→ x = 0,08; y = 0,18; z = 0,24
→ %Mg = 9,64%

Đáp án D
* Phần 1: nFe = nH2 = 0,1; nCu = a
* Phần 2: nNO2 = 1,25; nFe = 0,1k và nCu = ak
Ta có hệ
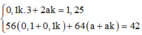
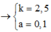
=> m = 0,25.242 + 0,25.188 = 107,5 gam

Đáp án C
Đặt số mol mỗi kim loại trong 18,5 gam hỗn hợp lần lượt là a, b, c.
Ta có: mhh X =65a + 56b + 64c; n H 2 = a + b = 3 , 92 22 , 4 = 0 , 175 mol
Có số phân tử Cl2 phản ứng trung bình với hỗn hợp X:
n Cl 2 n X = 0 , 175 0 , 15 = 7 6 = ( a + 1 , 5 b + c ) ( a + b + c )
Từ đó ta có a - 2b + c = 0.
Tóm lại ta sẽ có a = b = c = 0,1 mol.
Vậy trong 18,5g hỗn họp X sẽ có 0,1 mol Fe
Chú ý:
Dung dịch axit như dung dịch HCl, HBr, HI hoặc dung dịch H2SO4 có khả năng phản ứng với các kim loại đứng trước H trong dãy điện hóa, tức là trong bài này phản ứng với Zn và Fe tạo ra ZnCl2 và FeCl2.
- Clo có khả năng phản ứng với hầu hết các kim loại (trừ Au, Pt) thậm chí còn có khả năng phản ứng với Ag ở điều kiên thích hợp và đưa kim loại lên số oxi hóa cao nhất vì vậy sản phẩm là ZnCl2,CuCl2,FeCl3



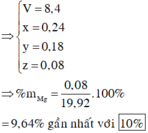
Đáp án B
Xét thì nghiệm 2:BT e có
Xét thí nghiệm 1 ta có
Gọi số mol của Fe,Mg,Cu là a,b,c (mol)
Ta có 56a+24b+64c=10,08 (2)
Khối lượng muối là 28,275=>162,5a+95b+135c=28,275(vì Fe tác dụng với Cl2 tạo FeCl3) (3)
Từ 1,2,3 ta có