Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\); \(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
Xét tỉ lệ: \(\dfrac{0,4}{1}< \dfrac{0,5}{1}\) => Fe hết, H2SO4 dư
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,4--->0,4-------->0,4--->0,4
=> VH2 = 0,4.22,4 = 8,96 (l)
b) Do trong dd sau pư có H2SO4 dư nên dd làm quỳ tím chuyển màu đỏ
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\\ n_{H_2SO_{\text{ 4 }}}=\dfrac{49}{98}=0,5\left(mol\right)\\ pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
LTL: 0,4<0,5 => Fe hết H2SO4 dư
theo pthh : nH2 = nFe =0,4(mol)
=> \(V_{H_2}=0,4.22,4=8,96\left(l\right)\)
dd là muối => nhưng có H2SO4 dư nên qt CHUYỂN đỏa

a,Số mol của 13,65 gam kali là:
\(n_K=\dfrac{m}{M}=\dfrac{13,65}{39}=0,35\left(mol\right)\)
\(2K+2H_2O\rightarrow2KOH+H_2\uparrow\)
2 : 2 : 2 : 1 (mol)
0,35-> 0,35 : 0,35 : 0,175 (mol)
Thể tích của 0,175 mol H2:
\(V_{H_2}=n.22,4=0,175.22,4=3,92\left(l\right)\)
Khối lượng của 0,35 mol KOH:
\(m_{KOH}=n.M=0,35.56=19,6\left(g\right)\)
c, dung dich KOH sau phản ứng có tính bazơ nên khi nhúng giấy quỳ tím vào thì quỳ tím hoá xanh

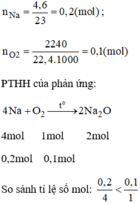
Vậy O 2 dư.
Sau phản ứng Na không dư nên không có khí H 2 bay ra, quỳ tím chuyển sang màu xanh vì:
N a 2 O + H 2 O → 2 N a O H

a) Na nóng chảy, chạy trên mặt nước, tan dần và có khí không màu thoát ra
PTHH: 2Na + 2H2O --> 2NaOH + H2 (pư oxi hóa-khử)
b) Sau pư, thu được dd bazo nên quỳ tím chuyển màu xanh
c) \(n_{H_2}=\dfrac{6,1975}{24,79}=0,25\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,5<----------------0,5<---0,25
=> mNa = 0,5.23 = 11,5 (g)
d) Sản phẩm tạo thành là NaOH (sodium hydroxide) và H2(hydrogen)
mNaOH = 0,5.40 = 20 (g)
mH2 = 0,25.2 = 0,5 (g)

a, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\), ta được HCl dư.
Theo PT: \(n_{H_2}=n_{Fe}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, - Nhúng quỳ tím vào dd thấy quỳ chuyển đỏ do HCl dư.
c, \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PT: \(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\), ta được CuO dư.
Theo PT: \(n_{CuO\left(pư\right)}=n_{Cu}=n_{H_2}=0,2\left(mol\right)\Rightarrow n_{CuO\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
⇒ mX = mCu + mCuO dư = 0,2.64 + 0,1.80 = 20,8 (g)

\(a)n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\\ 2Al+6HCl\xrightarrow[]{}2AlCl_3+3H_2\\ n_{H_2}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}\cdot0,4=0,6\left(mol\right)\\ V_{H_2}=0,6.22,4=13,44\left(l\right)\\ b)n_{HCl}=3n_{Al}=3.0,4=1,2\left(mol\right)\\ m_{HCl}=1,2.36,5=43,8\left(g\right)\\ m_{dd_{HCl}}=\dfrac{43,8}{10,95\%}\cdot100\%=400\left(g\right)\\ c)n_{AlCl_3}=n_{Al}=0,4mol\\ m_{AlCl_3}=0,4.133,5=53,4\left(g\right)\\ m_{H_2}=0,6.2=1,2\left(g\right)\\ m_{dd_{AlCl_3}}=10,8+400-1,2=409,6\left(g\right)\\ C_{\%AlCl_3}=\dfrac{53,4}{409,6}\cdot100\%\approx13\%\)

nNa = 4,6 : 23 = 0,2 (mol)
pthh: 2Na + 2H2O →2NaOH + H2
0,2 0,1 (mol)
=> VH2 = 0,1 . 22,4 = 2,24 L
dung dịch sau pư làm QT chuyển xanh

\(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\\ pthh:2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Mol : 0,4 0,4 0,6
\(m_{AlCl_3}=133,5.0,4=53,4\left(g\right)\\ V_{H_2}=0,6.22,4=13,44\left(l\right)\)
\(n_{CuO}=\dfrac{8}{80}=0,8\left(mol\right)\\
pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\\
LTL:\dfrac{0,8}{1}>\dfrac{0,6}{1}\)
=> CuO dư
\(n_{CuO\left(p\text{ư}\right)}=n_{Cu}=n_{H_2}=0,6\left(mol\right)\\
m_{CuO\left(d\right)}=\left(0,8-0,6\right).80=16\left(g\right)\\
m_{Cu}=0,6.64=38,4\left(g\right)\\
m_{cr}=16+38,4=54,4\left(g\right)\)

a)
$n_{HCl} = 0,2.2 = 0,4(mol)$
$n_{Zn} = \dfrac{9,75}{65}= 0,15(mol)$
$Zn + 2HCl \to ZnCl_2 + H_2$
Ta thấy :
n Zn / 1 = 0,15 < n HCl / 2 = 0,2 nên HCl dư
n H2 = n Zn = 0,15(mol)
V H2 = 0,15.22,4 = 3,36 lít
b)
n HCl pư = 2n Zn = 0,3(mol)
=> n HCl dư = 0,4 - 0,3 = 0,1(mol)
n ZnCl2 = n Zn = 0,15(mol)
CM HCl = 0,1/0,2 = 0,5M
CM ZnCl2 = 0,15/0,2 = 0,75M
c)
Dung dịch A làm quỳ tím hóa đỏ vì có HCl dư
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{9,75}{65}=0,15\left(mol\right)\\n_{HCl}=0,2\cdot2=0,4\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,4}{2}\) \(\Rightarrow\) HCl còn dư, Kẽm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{ZnCl_2}=n_{H_2}=0,15\left(mol\right)\\n_{HCl\left(dư\right)}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\\C_{M_{ZnCl_2}}=\dfrac{0,15}{0,2}=0,75\left(M\right)\\C_{M_{HCl\left(dư\right)}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\end{matrix}\right.\)
Vì HCl còn dư, nên dd sau p/ứ làm quỳ tím hóa đỏ
\(n_{Al}=\dfrac{10,8}{27}=0,4mol\)
\(n_{HCl}=\dfrac{49}{36,5}=1,34mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Xét: \(\dfrac{0,4}{2}\) < \(\dfrac{1,34}{6}\) ( mol )
0,4 1,2 0,4 0,6 ( mol )
\(V_{H_2}=0,6.22,4=13,44l\)
\(m_{AlCl_3}=0,4.133,5=53,4g\)
\(m_{HCl\left(dư\right)}=\left(1,34-1,2\right).36,5=5,11g\)
Nhúng quỳ tím vào dung dịch sau phản ứng thấy quỳ tím hóa đỏ, vì sau phản ứng dd HCl còn dư.