Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Gọi $n_{Zn} = a(mol) ; n_{Al} = b(mol) \Rightarrow 65a + 27b = 11,9(1)$
$Zn + 2HCl \to ZnCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Theo PTHH :
$n_{H_2} = a + 1,5b = \dfrac{8,96}{22,4} = 0,4(2)$
Từ (1)(2) suy ra : a = 0,1; b = 0,2
$m_{Zn} = 0,1.65 = 6,5(gam)$
$m_{Al} = 0,2.27 = 5,4(gam)$
b) $n_{HCl} = 2n_{H_2} = 0,8(mol)$
$C\%_{HCl} = \dfrac{0,8.36,5}{125}.100\% = 23,36\%$

a)\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: x 1,5x
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}27x+24y=5,1\\1,5x+y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,1.27.100\%}{5,1}=52,94\%;\%m_{Mg}=100-52,94=47,06\%\)
b)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: 0,1 0,15 0,05
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: 0,1 0,1 0,1
\(m_{ddH_2SO_4}=\dfrac{\left(0,1+0,15\right).98.100}{9,8}=250\left(g\right)\)
mdd sau pứ = 5,1+250-0,15.2 = 254,8(g)
\(C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{0,05.342.100\%}{254,8}=6,71\%\)
\(C\%_{ddMgSO_4}=\dfrac{0,1.120.100\%}{254,8}=4,71\%\)

- Từ giả thiết tính được : n Cl 2 = 0,035 mol; n O 2 = 0,025 mol
Theo ĐLBT khối lượng :
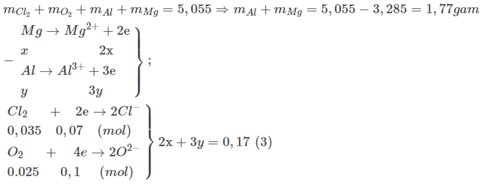
Từ (3)(4) ⇒ x = 0,04; y = 0,03
⇒ m Mg = 0,04.24 = 0,96g; m Al = 0,03.27 = 0,81g
Phản ứng không oxi hoá - khử

\(n_{H2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
a 0,4 0,2 1a
\(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
b 0,3 0,15 1b
a) Gọi a là số mol của Mg
b là số mol của Fe
\(m_{Mg}+m_{Fe}=13,2\left(g\right)\)
⇒ \(n_{Mg}.M_{Mg}+n_{Fe}.M_{Fe}=13,2g\)
⇒ 24a + 56b = 13,2g (1)
Theo phương trình : 1a + 1b = 0,35(2)
Từ(1),(2), ta có hệ phương trình :
24a + 56b = 13,2g
1a + 1b = 0,35
⇒ \(\left\{{}\begin{matrix}a=0,2\\b=0,15\end{matrix}\right.\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
0/0Mg = \(\dfrac{4,8.100}{13,2}=36,36\)0/0
0/0Fe = \(\dfrac{8,4.100}{13,2}=63,64\)0/0
b) \(n_{HCl\left(tổng\right)}=0,4+0,3=0,7\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddHCl}}=\dfrac{0,7}{0,2}=3,5\left(M\right)\)
c) \(m_{muối.clorua}=\left(0,2.95\right)+\left(0,15.127\right)=38,05\left(g\right)\)
Chúc bạn học tốt

Câu 1:
Gọi số mol Al là x; Zn là y
\(\rightarrow27x+65y=18,4\)
\(Al+3HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(\rightarrow n_{H2}=1,5n_{Al}+n_{Zn}=1,5x+y=\frac{1}{2}=0,5\left(mol\right)\)
Giải được: \(x=y=0,2\)
\(\Rightarrow m_{Al}=27x=5,4\left(g\right)\Rightarrow\%m_{Al}=\frac{5,4}{18,4}=29,3\%\Rightarrow\%m_{Zn}=70,7\%\)Câu 2:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeO+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{H2}=n_{Fe}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
Muối thu được là FeCl2
\(\rightarrow n_{FeCl2}=\frac{38,1}{56+35,5.2}=0,3\left(mol\right)\)
Ta có: \(n_{FeCl2}=n_{Fe}+n_{FeO}\rightarrow n_{FeO}=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right);m_{FeO}=0,2.\left(56+16\right)=14,4\left(g\right)\)
Câu 3 :
Cu không tác dụng với HCl, chỉ có Zn phản ứng.
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{H2}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
Theo phản ứng: \(n_{Zn}=n_{H2}=0,2\left(mol\right)\rightarrow m_{Zn}=0,2.65=13\left(g\right)\)
\(\rightarrow\%m_{Zn}=\frac{13}{20}=65\%\rightarrow\%m_{Cu}=35\%\)
Ta có: \(n_{HCl}=2n_{H2}=0,2.2=0,4\left(mol\right)\)
\(\Rightarrow V_{HCl}=\frac{0,4}{2}=0,2\left(l\right)\)
Câu 4:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Al+3HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
Gọi số mol Fe là x; Al là y
\(\rightarrow56x+27y=22\)
Ta có: \(n_{H2}=n_{Fe}=1,5n_{Al}=x+1,5y=\frac{17,92}{22,4}=0,8\left(mol\right)\)
Giải được: \(\rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,2.56=11,2\left(g\right)\)
\(\rightarrow\%m_{Fe}=\frac{11,2}{22}=50,9\%\rightarrow\%m_{Al}=49,1\%\)
Ta có: \(n_{HCl}=2n_{H2}=1,6\left(mol\right)\)
\(\rightarrow m_{HCl}=1,6.36,5=58,4\left(g\right)\)
\(\rightarrow m_{dd_{HCl}}=\frac{58,4}{7,3\%}=800\left(g\right)\)
Câu 5:
Gọi chung 2 kim loại là R hóa trị I
\(R+HCl\rightarrow RCl+\frac{1}{2}H_2\)
Ta có: \(n_{H2}=\frac{0,448}{22,4}=0,02\left(mol\right)\rightarrow n_{RCl}=2n_{H2}=0,04\left(mol\right)\)
\(\rightarrow m_{RCl}=0,04.\left(R+35,5\right)=2,58\rightarrow R=29\)
Vì 2 kim loại liên tiếp nhau \(\rightarrow\) 2 kim loại là Na x mol và K y mol
\(\rightarrow x+y=n_{RCl}=0,04\left(mol\right)\)
\(m_{hh}=m_R=23x+39y=0,04.29=1,16\left(g\right)\)
Giải được: \(\rightarrow\left\{{}\begin{matrix}x=0,025\\y=0,015\end{matrix}\right.\)
\(\rightarrow m_{Na}=0,575\left(g\right)\)
\(\rightarrow\%m_{Na}=\frac{0,575}{1,16}=49,57\%\rightarrow\%m_K=50,43\%\)
Câu 6:
Khối lượng mỗi phần là 35/2=17,5g
Gọi số mol Fe, Cu, Al là a, b, c
Ta có \(56a+64b=27c=17,5\)
Phần 1: \(n_{H2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow a=1,5b=n_{H2}=0,3\)
Phần 2: \(n_{Cl2}=\frac{10,64}{22,4}=0,475\left(mol\right)\)
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
\(Cu+Cl_2\rightarrow CuCl_2\)
\(2Al+3Cl_2\rightarrow2AlCl_3\)
\(\Rightarrow1,5a+b+1,5c=n_{Cl2}=0,465\)
\(\rightarrow\left\{{}\begin{matrix}a=0,15\\b=0,1\\c=0,1\end{matrix}\right.\)
\(\rightarrow\%m_{Fe}=\frac{0,15.56}{17,5}=48\%\)
\(\rightarrow\%m_{Cu}=\frac{0,1.64}{17,5}=36,57\%\)
\(\rightarrow\%m_{Al}=100\%-48\%-36,57\%=15,43\%\)
Câu 1
2Al+6HCl--->2Alcl3+3H2
x-----------------------1,5x
Zn+2HCl---->Zncl2+H2
y---------------------------y
n H2=1/2=0,5(mol)
Theo bài ta có hpt
\(\left\{{}\begin{matrix}27x+65y=18,4\\1,5x+y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
%m Al=0,2.27/18,4.100%=29,35%
%m Zn=100%-29,35=70,65%
Câu 2.
Fe+2HCl---->FeCl2+H2
FeO+2HCl--->FeCl2+H2
n H2=2,24/22,4=0,1(mol)
m H2=0,2(g)
n Fe=n H2=0,2(mol)
m Fe=0,2.56=11,2(g)
n FeCl2(1)=2n H2=0,2(mol)
m FeCl2(1)=0,2.127=25,4(g)
m FeCl2(PT2)=38,1-25,4=12,7(g)
n FeCl2=12,7/127=0,1(mol)
n FeO=n FeCl2=0,1(mol)
m FeO=0,1.72=7,2(g)
3.
Zn+2HCl--->ZnCl2+H2
n H2=4,48/22,4=0,2(mol)
n Zn=n H2=0,2(mol)
m Zn=0,2.56=11,2(g)
%m Zn=11,2/20.100%=56%
%m Cu=100-56=34%
b) n HCl=2n H2=0,4(mol)
V H2=0,4/2=0,2(l)
4.
a) Fe+2HCl---.FeCl2+H2
x-----------------------------x(mol)
2Al+6HCl--->AlCl3+3H2
y------------------------------1,5y
n H2=17,92/22,4=0,89mol)
Theo bài ta có hpt
\(\left\{{}\begin{matrix}56x+27y=22\\x+1,5y=0,8\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\)
%m Fe=0,2.56/22.100%=50,9%
%m Al=100-50,9=49,1%
b) n HCl=2n H2=1,6(mol)
m HCl=1,6.36,5=58,4(g)
m dd HCl=58,4.100/7,3=800(g)

Chọn đáp án B
n X = 7 , 84 22 , 4 = 0,35 (mol)
Bảo toàn khối lượng: m C l 2 + m O 2 = 30,1 – 11,1 = 19 (gam)
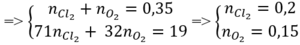

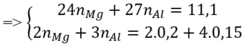
=> n M g = 0 , 35 n A l = 0 , 1 => %mAl = 0 , 1 . 27 11 , 1 .100% = 24,32%





a) nCl2=7,28/22,4=0,325(mol)
=> mCl2=0,325.71=23,075(mol)
=> m(muối)= m(hh)+ mCl2= 10,45+23,075=33,525(g)
b) PTHH: 2 Al + 3 Cl2 -to-> 2 AlCl3
a__________1,5a(mol)
Cu + Cl2 -to-> CuCl2
b___b(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}27a+64b=10,45\\1,5a+b=0,325\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,15\\b=0,1\end{matrix}\right.\)
=> mCu=0,1.64=6,4(g)
=>%mCu= (6,4/10,45).100=61,244%
=>%mAl=38,756%