Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\left\{{}\begin{matrix}n_{NaOH}=0,3.2=0,6\left(mol\right)\\n_{Fe_2\left(SO_4\right)_3}=0,2.0,5=0,1\left(mol\right)\\n_{H_2SO_4}=0,2.0,5=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\left\{{}\begin{matrix}n_{Na^+}=0,6\left(mol\right)\\n_{Fe^{3+}}=0,1.2=0,2\left(mol\right)\\n_{H^+}=0,1.2=0,2\left(mol\right)\end{matrix}\right.\\\left\{{}\begin{matrix}n_{SO_4^{2-}}=0,1.3+0,1=0,4\left(mol\right)\\n_{OH^-}=0,6\left(mol\right)\end{matrix}\right.\end{matrix}\right.\)
PT ion rút gọn:
\(H^++OH^-\rightarrow H_2O\)
0,2-->0,2
\(Fe^{3+}+3OH^-\rightarrow Fe\left(OH\right)_3\downarrow\)
\(\dfrac{2}{15}\)<----0,4--------->\(\dfrac{2}{15}\)
\(\Rightarrow m=\dfrac{2}{15}.107=\dfrac{214}{15}\left(g\right)\)
dd sau phản ứng có: \(\left\{{}\begin{matrix}n_{Na^+}=0,6\left(mol\right)\\n_{Fe^{3+}\left(d\text{ư}\right)}=0,2-\dfrac{2}{15}=\dfrac{1}{15}\left(mol\right)\\n_{SO_4^{2-}}=0,4\left(mol\right)\end{matrix}\right.\)
\(V_{\text{dd}}=0,3+0,2=0,5\left(l\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{Na^+}=\dfrac{0,6}{0,5}=1,2M\\C_{Fe^{3+}}=\dfrac{\dfrac{1}{15}}{0,5}=\dfrac{2}{15}M\\C_{SO_4^{2-}}=\dfrac{0,4}{0,5}=0,8M\end{matrix}\right.\)

Bảo toàn điện tích : $x = \dfrac{0,12 + 0,05 - 0,12}{2} = 0,025(mol)$
$n_{Ba^{2+}} = n_{Ba(OH)_2} = 0,3.0,1 = 0,03(mol)$
$n_{OH^-} = 2n_{Ba(OH)_2} = 0,06(mol)$
$Ba^{2+} + SO_4^{2-} \to BaSO_4$
$NH_4^+ + OH^- \to NH_3 + H_2O$
Suy ra, dung dịch gồm :
$Na^+ : 0,12(mol)$
$Cl^- : 0,12(mol)$
$OH^- : 0,06 - 0,05 = 0,01(mol)$
$Ba^{2+} : 0,03 - 0,025 = 0,005(mol)$
Suy ra: $m = 0,12.23 + 0,12.35,5 + 0,01.17 + 0,005.137 = 7,875(gam)$

$n_{Ba^{2+}} = 0,1.0,5 = 0,05 < n_{SO_4^{2-}} = 0,1$ nên $SO_4^{2-}$ dư
$n_{BaSO_4} = n_{Ba^{2+}} = 0,05(mol)$
$m_{BaSO_4} = 0,05.233 = 11,65(gam)$
$n_{OH^-} = 0,1.0,5.2 + 0,1.0,5 = 0,15(mol)$
$n_{H^+} = 0,1.2 = 0,2(mol)$
$H^+ + OH^- \to H_2O$
$n_{H^+\ dư} = 0,2 - 0,15 = 0,05(mol)$
$V_{dd} = 0,1 + 0,1 + 0,1 = 0,3(lít)$
$[H^+] = \dfrac{0,05}{0,3} = \dfrac{1}{6}M$
$pH = -log( \dfrac{1}{6} ) = 0,778$
\(n_{Ba^{2+}}=0.1\cdot0.5=0.05\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.5\cdot2+0.1\cdot0.5=0.15\left(mol\right)\)
\(n_{H^+}=2\cdot0.1\cdot1=0.2\left(mol\right)\)
\(n_{SO_4^{2-}}=0.1\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.05.........0.05.............0.05\)
\(SO_4^{2-}dư\)
\(m_{\downarrow}=0.05\cdot233=11.65\left(g\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.15.......0.15\)
\(n_{H^+\left(dư\right)}=0.2-0.15=0.05\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.05}{0.1+0.1+0.1}=\dfrac{1}{6}\)
\(pH=-log\left(\dfrac{1}{6}\right)=0.77\)

Đáp án A
nHCl = 0,15 ; nNa2CO3 = 0,5x; nCO2 = 0,045 mol
H+ + CO32- → HCO3-
0,5x← 0,5x
H+ + HCO3- → CO2 + H2O
0,045 ← 0,045
BT mol H+ => 0,5x + 0,045 = 0,15 => x = 0,105 mol

Khi thêm 1ml dung dịch \(MgCl_21M\) vào 100 ml dung dịch đệm thì
\(C_{Mg^{2+}}\)ban đầu=\(10^{-2}\left(M\right)\)
Ta có \(T_{Mg\left(OH\right)_2}=\left[Mg^{2+}\right]\left[OH^-\right]^2=10^{-10,95}\)
Để kết tủa \(Mg\left(OH\right)_2\) thì \(\left[Mg^{2+}\right]\left[OH^-\right]^2\ge10^{-10,95}\)
⇒\(\left[OH^-\right]^2\ge\frac{10^{-10,95}}{Mg^{2+}}=\frac{10^{-10,95}}{10^{-2}}=10^{-8,95}\).Hay OH- ≥\(10^{-4,475}\)
Dung dịch \(NH_4Cl\) 1M \(+NH_3\) 1M cân bằng chủ yếu là
\(NH_3+H_2O\Leftrightarrow NH_4^++OH^-\)
1 1 \(K_{NH_3}=K_b=10^{-4,75}\)
1-x 1+x x
\(K_b=\frac{\left(x+1\right)x}{1-x}=10^{-4,75}\)
⇒ \(x=10^{-4,75}\) hay \(\left[OH^-\right]=10^{-4,75}< 10^{-4,475}\)
Vậy khi thêm 1 ml dung dịch \(MgCl_21M\) vào 100 ml dung dịch \(NH_31M\) và \(NH_4Cl\) 1M thì không xuất hiện kết tủa \(Mg\left(OH\right)_2\)
Tham khảo!
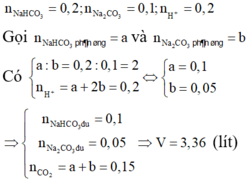
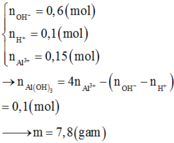
uiii cảm ơn ạ