Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
► Bảo toàn electron: 3nAl = 2nH2 ⇒ nAl = 0,02 mol.
"vừa đủ" ⇒ X chỉ chứa AlCl3 || 0,09 mol hay 0,13 mol NaOH cho cùng 1 lượng ↓
⇒ 0,09 mol NaOH thì ↓ chưa đạt cực đại và 0,13 mol NaOH thì ↓ bị hòa tan 1 phần.
⇒ n↓ = 0,09 ÷ 3 = 0,03 mol. ||► Mặt khác, khi bị hòa tan 1 phần thì:
nOH– = 4nAl3+ – n↓ ⇒ nAl3+ = (0,03 + 0,13) ÷ 4 = 0,04 mol.
Bảo toàn nguyên tố Al: nAl2O3 = 0,01 mol ||⇒ m = 1,56(g)

Đáp án B
Ta có:
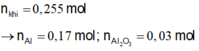
Dung dịch Y chứa 0,23 mol AlCl3.
Cho dung dịch chứa 0,3 mol Ba(OH)2 và 0,37 mol NaOH tác dụng với Y thu được dung dịch Z.
Z chứa Ba2+ 0,3 mol, Na+ 0,37 mol, AlO2- 0,23 mol, OH- dư 0,05 mol.
Cho H2SO4 vào Z.
Để kết tủa Al(OH)3 lớn nhất thì :
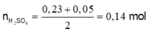
Để kết tủa BaSO4 lớn nhất thì : n H 2 S O 4 = 0 , 3 m o l
Lúc kết tủa BaSO4 tối đa thì Al(OH)3 bị hòa tan nhưng lượng BaSO4tạo thành lớn hơn Al(OH)3 bị hòa tan nên kết tủa vẫn tăng


Đáp án B
Ta có: n k h i = 0 , 255 m o l
![]()
Dung dịch Y chứa 0,23 mol AlCl3.
Cho dung dịch chứa 0,3 mol Ba(OH)2 và 0,37 mol NaOH tác dụng với Y thu được dung dịch Z.
Z chứa Ba2+ 0,3 mol, Na+ 0,37 mol, AlO2- 0,23 mol, OH- dư 0,05 mol.
Cho H2SO4 vào Z.
Để kết tủa Al(OH)3 lớn nhất thì :
n H 2 S O 4 = 0 , 23 + 0 , 05 2 = 0 , 14 m o l
Để kết tủa BaSO4 lớn nhất thì : n H 2 S O 4 = 0 , 3
Lúc kết tủa BaSO4 tối đa thì Al(OH)3 bị hòa tan nhưng lượng BaSO4tạo thành lớn hơn Al(OH)3 bị hòa tan nên kết tủa vẫn tăng
→ V = 0 , 3 2 = 150 m l

Đáp án A
P1: nFe(OH)2 = 3,6/90 = 0,04 mol => nFe2+ = 0,04 mol
P2:
Fe2+: x mol
H+: y mol
Cl-: 2x + y
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
0,06 ← 0,08 ← 0,02
=> y = 0,08
Fe2+ + Ag+ → Fe3+ + Ag
x-0,06 → x-0,06
Ag+ + Cl- → AgCl
2x+y → 2x+y
=> 108(x-0,06) + 143,5(2x+y) = 68,2 => x = 0,16
=> nFe phản ứng ban đầu = nH2 = 0,04+0,16 = 0,2 mol => VH2 = 4,48 lít

Đáp án A
P1: nFe(OH)2 = 3,6/90 = 0,04 mol
=> nFe2+ = 0,04 mol
P2:
Fe2+: x mol
H+: y mol
Cl-: 2x + y
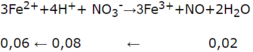
=> y = 0,08
Fe2++Ag+→Fe3++Ag
x-0,06 → x-0,06
Ag+ + Cl- → AgCl
2x+y → 2x+y
=> 108(x-0,06) + 143,5(2x+y) = 68,2 => x = 0,16
=> nFe phản ứng ban đầu = nH2 = 0,04+0,16 = 0,2 mol => VH2 = 4,48 lít

P1: nFe(OH)2 = 3,6/90 = 0,04 mol => nFe2+ = 0,04 mol
P2:
Fe2+: x mol
H+: y mol
Cl-: 2x + y
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
0,06 ← 0,08 ← 0,02
=> y = 0,08
Fe2+ + Ag+ → Fe3+ + Ag
x-0,06 → x-0,06
Ag+ + Cl- → AgCl
2x+y → 2x+y
=> 108(x-0,06) + 143,5(2x+y) = 68,2 => x = 0,16
=> nFe phản ứng ban đầu = nH2 = 0,04+0,16 = 0,2 mol => VH2 = 4,48 lít
Đáp án A

+ Tính được những gì có thể tính được
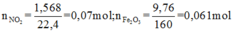
+ Với bài toán gồm nhiều giai đoạn liên tiếp nhau như thế này ta nên tóm tắt lại bài toán:
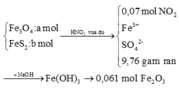
Bây giờ ta phải thiết lập được mối quan hệ giữa a và b với hi vọng là tìm được a và b rồi sau đó áp dụng các định luật bảo toàn như khối lượng, nguyên tố, electron ....
+ Bảo toàn nguyên tố Fe: 3a + b = nFe = 2.0,061 = 0,122
+ Bảo toàn sốmol electron trao đổi: a + 15b = 0,07.1 ( Chú ý FeS2→Fe3+ + 2S+6 + 15e)
Giải được a = 0,04; b = 0,002.
+ Tiếp tục sử dụng bảo toàn nguyên tố S:
![]()
+ Vì phản ứng xảy ra hoàn toàn và vừa đủ nên sau khi phản ứng với dung dịch NaOH ta chỉ thu được 2 muối là Na2SO4 và NaNO3.
Áp dụng định luật bảo toàn nguyên tố Na:
![]()
+ Cuối cùng dựa vào sơ đồ tóm tắt, ta sẽ dùng bảo toàn nguyên tố N
![]()
=>![]()
Đáp án D

nHCl = 0,2.2.5 =0,5 mol
Fe + 2HCl → FeCl2 + H2
x 2x x x (mol)
2Al + 6HCl → 2AlCl3 + 3H2
y 3y y 3/2y (mol)
Phản ứng vừa đủ nên ta có
Bảo toàn nguyên tố H ==> nH2 thu được = 0,25 mol ==> VH2 = 0,25.22,4 =5,6 lít
Gọi số mol Fe, Al lần lượt là x, y ta có hệ pt:\(\left\{{}\begin{matrix}56x+27y=8,3\\2x+3y=0,5\end{matrix}\right.\)
==> x = 0,1 và y = 0,1 mol
dd A gồm \(\left\{{}\begin{matrix}FeCl2\\AlCl3\end{matrix}\right.\) + 0,6 mol NaOH , NaOH dư nên kết tủa Al(OH)3 sinh ra bị hòa tan hết . Kết tủa Z thu được chỉ có Fe(OH)2 0,1 mol
Fe(OH)2 nung trong không khí ==> Fe2O3 0,05 mol
mChat rắn = mFe2O3= 0,05. 160= 8 gam
