Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(C_2H_2+\dfrac{5}{2}O_2-^{t^o}\rightarrow2CO_2+H_2O\\ CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
\(n_{C_2H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{CO_2}=2n_{C_2H_2}=0,3\left(mol\right)\\ n_{H_2O}=n_{C_2H_2}=0,15\left(mol\right)\\ m_{b\uparrow}=m_{CO_2}+m_{H_2O}=0,3.44+0,15.18=15,9\left(g\right)\\ n_{CO_2}=n_{CaCO_3}=0,3\left(mol\right)\\ m_{kt}=m_{CaCO_3}=0,3.100=30\left(g\right)\)

Đồng nhất dữ kiện các phần để tiện tính toán, bằng cách nhân khối lượng Br2 với 2. Bình H2SO4 đặc hấp thụ H2O, bình KOH đặc hấp thụ CO2. Khối lượng bình tăng chính là khối lượng khí hoặc hơi mà bình đó hấp thụ
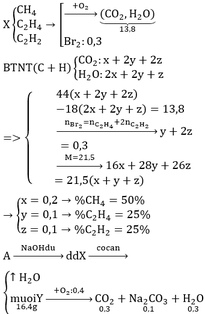
Vì bay hơi chỉ có nước, mà A tác dụng được với NaOH nên A chỉ chứa gốc phenol hoặc gốc cacboxylic (–COOH).
BTKL:
mY + mO2 = mCO2 + mNa2CO3 + mH2O => mO2 = 12,8g => nO2 = 0,4mol
BTNT O: nO(Y) + 2nO2 = 2nCO2 + 3nNa2CO3 + nH2O
=> nO(Y) = 0,4
=> nC : nH: nO: nNa = 0,4 : 0,6 : 0,4 : 0,2 = 2:3:2:1
=> C2H3O2Na => A: C2H4O2
(Vì A chứa gốc phenol (–OH) hoặc axit (–COOH) nên 1Na sẽ thế 1H).


Do lấy dư 20% oxi so với lượng cần đốt cháy nên lượng oxi đã lấy là:


Tổng khối lượng CO2 và SO2 :
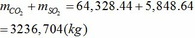
Chú ý:
Lượng O2 lấy dư 20% so với với lượng cần thiết => tính mol O2 chính xác
