Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chất rắn gồm : Ag,Cu dư
\(n_{Ag} = n_{AgNO_3} = 0,1(mol)\\ \Rightarrow n_{Cu} = \dfrac{15,92-0,1.108}{64} = 0,08(mol)\)
Gọi \(n_{Cu} = n_{Fe} = a(mol)\)
Dung dịch sau phản ứng :
\(Fe^{2+} : a + 0,14\\ Cu^{2+} : a - 0,08\\ NO_3^- : 0,1 + 0,14.3 = 0,52(mol)\)
Bảo toàn điện tích : 2(a+0,14) + 2(a -0,08) = 0,52
⇒ a = 0,1
Vậy \(n_{Fe^{2+}} = a + 0,14 = 0,24(mol)\)
Bảo toàn e :
\(n_{Fe^{2+}} = 3n_{NO}\\ \Rightarrow n_{NO} = \dfrac{0,24}{3} = 0,08(mol)\\ \Rightarrow V = 0,08.22,4 = 1,792(lít)\)
Đáp án C

Có lẽ đề cho nung kết tủa trong không khí chứ không phải "để" bạn nhỉ?
PT: \(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
____0,04_____0,04_____0,04 (mol)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
0,03_____0,03______0,03 (mol)
⇒ nCuSO4 dư = 0,1 - 0,04 - 0,03 = 0,03 (mol)
- Dung dịch X gồm: ZnSO4: 0,04 (mol), FeSO4: 0,03 (mol) và CuSO4: 0,03 (mol)
PT: \(ZnSO_4+Ba\left(OH\right)_2\rightarrow Zn\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
______0,04__________________0,04______0,04 (mol)
\(Zn\left(OH\right)_2+Ba\left(OH\right)_2\rightarrow BaZnO_2+2H_2O\)
\(FeSO_4+Ba\left(OH\right)_2\rightarrow Fe\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
0,03____________________0,03______0,03 (mol)
\(CuSO_4+Ba\left(OH\right)_2\rightarrow Cu\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
0,03____________________0,03_______0,03 (mol)
- Kết tủa thu được gồm: Fe(OH)2: 0,03 (mol), Cu(OH)2: 0,03 (mol) và BaSO4: 0,1 (mol)
PT: \(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
_________0,03_________0,015 (mol)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
0,03_________0,03 (mol)
⇒ m = mFe2O3 + mCuO + mBaSO4 = 0,015.160 + 0,03.80 + 0,1.233 = 28,1 (g)

Gọi : \(\left\{{}\begin{matrix}n_{KF}=a\left(mol\right)\\n_{KCl}=a\left(mol\right)\\n_{KBr}=3a\left(mol\right)\\n_{KI}=3a\left(mol\right)\end{matrix}\right.\)⇒ 58a + 74,5a + 3a.119 + 3a.166=98,75
⇒ a = 0,1
KCl + AgNO3 → AgCl + KNO3
0,1........................0,1....................(mol)
KBr + AgNO3 → AgBr + KNO3
0,3.........................0,3......................(mol)
KI + AgNO3 → AgI + KNO3
0,3....................0,3.............................(mol)
Vậy :
a = 0,1.143,5 + 0,3.188 + 0,3.235 = 141,25(gam)
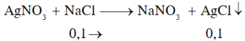

Do C2H2 và Ankin X có tỉ lệ là 1:1 nên \(n_{C2H2}=n_X=\frac{0,1}{2}=0,05\left(mol\right)\)
\(PTHH:C_2H_2+2AgNO_3+2NH_3\rightarrow C_2Ag_2+2NH_4NO_3\)
_________0,05_______________________0,05____________
mkết tủa của C2H2 khi td với dd là: 0,05.(12.2+ 108.2)=12g
Các ankin còn lại khí tác dụng với dd AgNO3/NH3 đều có chung công thức
\(C_nH_{2n-2}+AgNO_3+NH_3\rightarrow C_2H_{2n-1}Ag+NH_4NO_3\)
0,05 _______________________0,05
\(\Rightarrow m_{kt.cua.X}=19,35-12=7,35\left(g\right)\)
\(M=\frac{7,35}{0,05}=147\left(C_3H_3Ag\right)\)
Nên ankin X là C3H4
Do C2H2 và Ankin X có tỉ lệ là 1:1 nên nC2H2=nX=0,1/2=0,05 mol
PTHH: C2H2+2AgNO3+2NH3-->C2Ag2↓+2NH4NO3
0,05------------------------- --> 0,05
mkết tủa ccuar C2H2 khi td với dd là: 0,05.(12.2+ 108.2)=12g
Các ankin còn lại khí tác dụng với dd AgNO3/NH3 đều có chung công thức
CnH2n-2+AgNO3+NH3--> CnH2n-1 Ag+ NH4NO3
0,05 ------------------------ --> 0,05
m kết tủa của X= 19,35-12=7,35 g
M=m/n=7,35/0,05=147 (C3H3Ag)
Nên ankin X là C3H4