Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B

→ 45 , 2 g c r Y → + H 2 S O 4 0 , 35 m o l S O 2
Giả sử chất rắn Y gồm Ag (a mol), Cu (2a mol)
m Y = m Ag + m Cu ⇔ 108 a + 64 . 2 a = 45 , 2 ⇔ a = 0 , 192 mol
n e n h ư ờ n g = n A g + 2 n C u = 0 , 192 + 2 . 2 . 0 , 192 = 0 , 96 > 2 n S O 2 = 2 . 0 , 35 = 0 , 7 m o l
=> Mg và Al phản ứng hết và Cu2+ dư.
Ta có hệ pt:
108 n Ag + 64 n Cu = 45 , 2 n Ag + 2 n Cu = 2 n SO 2 = 0 , 7 ⇔ n Ag = 0 , 3 = a n Cu = 0 , 2

Dễ thấy Y gồm CO2 và CO dư với số mol là x và y ⇒ nCO2 = n↓ = 0,075 mol.
► MY = 40. Dùng sơ đồ đường chéo: nCO dư : nCO2 = 1 : 3 ⇒ nCO dư = 0,025 mol.
⇒ nCO ban đầu = 0,025 + 0,075 = 0,1 mol ⇒ nSO2 = 0,1 × 0,75 = 0,075 mol. Lại có:
2H2SO4 + 2e → SO2 + SO42– + 2H2O || [O] + H2SO4 → SO4 + H2O.
⇒ nO/X = 0,21 – 0,075 × 2 = 0,06 mol ⇒ mKL/X = 6 - 0,06 × 16 = 5,04(g).
● Giả sử hóa trị cao nhất của kim loại là n. Bảo toàn electron:
nKL = (0,075 × 2 + 0,06 × 2) ÷ n = 0,27 ÷ n ⇒ M = 5,04 ÷ (0,27 ÷ n) = 56n ÷ 3.
⇒ n = 3 và M = 56 (Fe) ⇒ nFe = 0,09 mol. ∑nO/oxit ban đầu = 0,06 + 0,075 = 0,135 mol.
⇒ Fe : O = 0,09 ÷ 0,135 = 2 : 3 ⇒ Fe2O3 ⇒ ∑số nguyên tử = 5 ⇒ chọn A.
Đáp án A

Đáp án A
Đặt nFeO = 2x mol; n F e 3 O 4 = x mol
→nFe = 2x+3x = 5x mol; nO = 2x+ 4x = 6x mol
20 gam hỗn hợp rắn Y có chứa Fe và O
→mO (trong Y) = mY - mFe = 20-5x.56 gam
→mO (đã phản ứng) = mO (X) - mO (Y) = 6x.16- (20-5x.56) = 376x-20 (gam)
→nO (đã phản ứng)= 376 x - 20 16 ( m o l ) = nCO pứ
CO+ m gam X→ 20 gam Y + H2SO4 đặc nóng dư→ Fe2(SO4)3+ SO2
Ta có: n S O 2 = 5,6/22,4 = 0,25 mol
- Quá trình cho e:
C+2 → C+4+ 2e
Fe→ Fe3++ 3e
5x → 15x mol
- Quá trình nhận e:
S+6+ 2e→ SO2
0,5← 0,25 mol
O + 2e →O-2
Bản chất phản ứng khử oxit sắt: CO + O(oxit) → CO2
Áp dụng định luật bảo toàn e: ne cho = ne nhận
→ 2 . 376 x - 20 16 +15x = 0,5+ 6x.2→ x = 0,06 mol
→m = 72.2x+ 232x = 22,56 gam


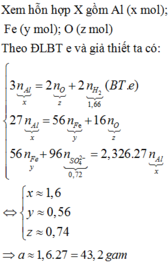

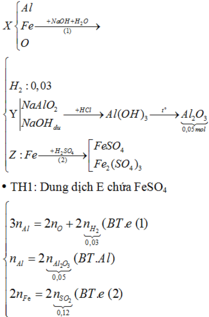

Chọn đáp án A