Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
Phần 1:
![]()
Phần 2:
Dung dịch Y có nồng độ H+ cao hơn nên pH nhỏ hơnX.

Đáp án A
- P1: hỗn hợp rắn X + HCl → H2 => chứng tỏ Fe dư, Cu2+ phản ứng hết.
Fe + 2HCl → FeCl2 + H2
=> nFe(1) = nH2 = 2,24: 22,4 = 0,1 mol
- P2: X + HNO3 → NO => Cả Fe và Cu đều phản ứng
Giả sử số mol ở phần 2 gấp k lần phần 1. Gọi số mol Cu phần 1 là a
Bảo toàn electron: 3nFe(2) + 2nCu(2) = 3nNO = 3.6,72: 22,4 = 0,9 mol
=> 3.0,1k + 2.ak = 0,9 (*)
Bảo toàn nguyên tố Cu: nCuSO4 = nCu(1) + nCu(2) => 0,2 = a + ak => a = 0 , 2 k + 1
Thay vào (*) =>0,3k + 2k. 0 , 2 k + 1 = 0,9
=> k = 2,097
- Vì Fe dư sau phản ứng nên: nFe pứ = nCuSO4 = 0,2 mol
=> nFe = nFe pứ + nFe(1) + nFe(2) = 0,3 + 0,1k = 0,5097 mol
=> mFe = 28,5432g (Gần nhất với giá trị 28,2g)

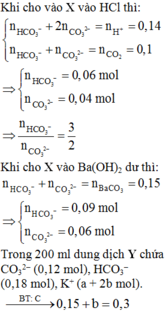
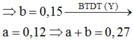


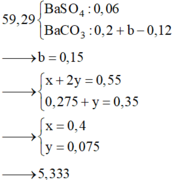
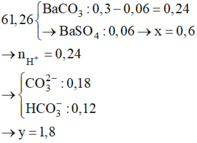

Chọn B