Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nhận thấy hợp chất A có dạng X2Y.
Dễ nhận thấy X+ trong tất cả các đáp án là NH4+ hoặc lập luận như sau:
• Với ion X+ chứa 5 hạt nhân của 2 nguyên tố → X có dạng AaBb+ với a+ b = 5
Trong X+ có 10 electron → Ztb =
10
+
1
5
= 2,2 → trong X chắc chắn chứa H → X có dạng HaBb
Với a = 1, b= 4 → ZB =
11
-
1
4
= 2,5 loại
Với a = 2, b= 3 → ZB =
11
-
2
3
= 3 ( loại do B(Z= 3) không tạo được liên kết ion với H)
Với a = 3, b= 2 → ZB =
11
-
3
2
= 4 ( Loại do không tồn tại ion C2H3+)
Với a= 4, b= 1 → ZB =
11
-
4
1
= 7 (N) → X là NH4+ ( thỏa mãn)
•Trong ion Y2- có bốn hạt nhân → Y có dạng CcDd với c + d= 4 ( Loại C, D)
Trong ion Y2- có bốn hạt nhân thuộc hai nguyên tố trong cùng một chu kì và đứng cách một ô trong bảng hệ thống tuần hoàn. → ZD = ZC + 2
Với c=1, d= 3 → ZC + 3. (ZC +2) = 30 → ZC = 6 ( C) → ZD = 8(O). Vậy Y2- có công thức CO32-.
Với c= 2,d= 2 → 2ZC + 2. (ZC +2) = 30 → ZC = 6,5 ( loại)
Với c= 3, d= 1→ 3ZC + (ZC +2) = 30 → ZC = 7 (N), ZD = 9 (F) → loại do không tạo được ion N3F2-.
Công thức của A là (NH4)2CO3.
Đáp án A.

Cấu hình X: 1s22s22p63s23p5
=> X có 17e,17p,Z=17, có 3 lớp electron và 7 electron hóa trị.
Y thuộc chu kì IV, nhóm VB, là kim loại chuyển tiếp.
=>
Các kim loại chuyển tiếp có 4 tính chất cơ bản:
Tạo hợp chất có màu.Có thể có nhiều trạng thái oxy hóa khác nhau.Là chất xúc tác tốt.Tạo phức chất.
Xác định X+
X+ có 10 electron nên tổng proton trong 5 hạt nhân là 11
Z = 2,2. Vậy có 1 nguyên tử là H
Gọi nguyên tử thứ hai trong X+ là R, công thức X+ có thể là;
RH4+ : ZR + 4 = 11 → ZR = 7 (N) ; X+: NH4+ (nhận)
R2H3+ : 2ZR + 3 = 11 ZR = 4 loại : R3H2+ : 3ZR + 2 = 11 ZR = 3 loại
Xác định Y2-
Y2- có 32 eletron nên tổng số hạt proton trong 4 nguyên tử là 30.
= 7,5 2 nguyên tử trong Y2- đều thuộc cùng chu kỳ 2.
Gọi 2 nguyên tử là A, B: ZB = ZA +2
Công thức Y2- có thể là
AB32- : ZA + 3ZB = 30
ZB= ZA +2 ZA= 6 (C); ZB = 8 (O)
A2B22- : 2ZA+ 2ZB = 30
ZB = ZA + 2 ZA= 6,5; ZB = 8,5 loại
A3B2- : 3ZA + ZB = 30
ZB = ZA + 2 ZA = 7; ZB = 9 loại
Hợp chất A có công thức (NH4)2CO3
Ta có trong X+ nhé
Có 2 nguyên tố là a và b
Vì có 5 hạt nhân tức là có 5 nguyên tử mà chỉ có 10 e -> Chắc chắn phải có Hidro ( chứ nếu sang tới B là có tới 3 e rồi!)
Biện luận về số nguyên tử hidro và số e của nguyên tố còn lại (ntcl)<--- lưu ý là ion X+ có 10 -> tổng 2 nguyên tố có đến 11 e
Số Hidro : 1------2------3-----4
Số ntcl : 4------3------2-----1
Số e của ntcl:2.5----3------4-----7
Ta thấy chỉ có giá trị 4-1-7 là phù hợp bởi vì 2,5 lẻ bị loại, 3,4 là các nguyên tố kim loại ko tạo ion với Hiđro
Tra bảng tuần hoàn ta có số hiệu 7 là nguyên tố Nitơ. -> X+ là NH4+
Tổng số e trong Y 2- là 32 <=> tổng số e của 4 nguyên tố tạo nên Y2- là 30
Gọi số e của nguyên tố thứ nhất là a thì̀ số e của nguyên tố thứ 2 là a+2
lại gọi thêm số nguyên tử của 2 nguyên tố lần lượt là x,y thì ta có
x+y=4
xa + y(a+2) = 30 <=> xa + ya =28 - 2y <=> (x+y)a= 28 - 2y <=> 4a = 28 - 2y
biện luận
y-----1---------2---------3
a----6.5-----6.25------6
tới đây dừng vì y<4 ta thấy có 1 nguyên tố có 1 nguyên tử mang số hiệu 6 (oxi) -> nguyên tố còn lại mang số hiệu 8 (cacbon) và có 3 nguyên tử -> Y2- là CO3(2-)
-> A chính là ..... (NH4)2CO3

Đáp án A.
Ta xét hai trường hợp sau:
- Nếu X và Y thuộc chu kì nhỏ thì ta có
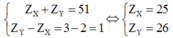
(loại do nhóm IIA và IIIA)
Nếu X và Y thuộc chu kì lớn thì ta có
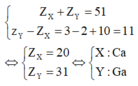
Nhận xét các đáp án:
A đúng: Ca không khử được ion Cu2+ trong dung dịch vì khi cho Ca vào dung dịch chứa Cu2+ thì Ca phản ứng với H2O có trong dung dịch trước:
![]()
Sau đó Cu2+ sẽ phản ứng với OH-:
![]()
B sai: Ở nhiệt độ thường Ca khử được H2O:
![]()
C sai: Hợp chất của Ca với oxi là CaO
D sai: Trong nguyên tử Ca có 20 proton

X tạo bởi chất ion với clo có công thức là XC1, vậy X là kim loại có hoá trị I.
Y cùng số nhóm với X vậy cũng có hoá trị I, công thức clorua của nó là YC1.
Ta có:
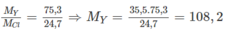
( M Y và M Cl lần lượt là NTK của nguyên tố Y và nguyên tố clo). Đó là Ag. Nguyên tố X cùng chu kì, cùng số thứ tự nhóm với Ag là kali (K))

C
Nguyên tố Y là nguyên tố thuộc nhóm B nên cấu hình electron lớp sát ngoài cùng và ngoài cùng có dạng: 3 d a 4 s 2 (hoặc 3 d b 4 s 1 trong trường hợp Cr và Cu).
Vậy số electron hóa trị của Y≥3. Y là kim loại, Y không có phân lớp f.
Nguyên tố X là nguyên tố thuộc nhóm A, có ≥3 electron hóa trị (vì cùng số electron hóa trị với Y).
=> electron cuối cùng của X sẽ nằm trên phân lớp p (x là nguyên tố p)
Chưa thể xác định được X và kim loại hay phi kim.

Chọn B
![]()
X và Y thuộc cùng một chu kì và hai nhóm liên tiếp (nhóm IIA và IIIA) nên ta có các trường hợp sau


Ở nhiệt độ thường X khử được nước, không khử được ion C u 2 + trong dung dịch (do sẽ phản ứng với nước trước), hợp chất với oxi có dạng CaO, trong X có 20 proton.
Dễ thấy :
Với X , từ I2 lên I3 tăng đột ngột , vậy ion \(X^{2+}\) có cấu hình của một khí hiếm nên :
\(X:\left[Ar\right]4s^2\left(Ca\right)\)
Với Y , từ I4 lên I5 tăng đột ngột , vậy ion \(I^{4+}\)có cấu hình của một khí hiếm nên :
\(Y:\left[He\right]2s^22p^2\left(C\right)\)
Vậy ...
P/s : bài này mk có lm rồi :D
thính cho mấy bạn COPIER à Đề Thi Môn Hóa 10 Kỳ Thi Olympic Truyền Thống 30/4 - Khoaluan.vn