Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 6.
\(n_{O_2}=\dfrac{16,8}{22,4}=0,75mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
1,5 0,75
\(m_{KMnO_4}=1,5\cdot158=237g\)
Câu 7.
\(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,04 0,02
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(\dfrac{2}{75}\) 0,04
\(m_{KClO_3}=\dfrac{2}{75}\cdot122,5=\dfrac{49}{15}\approx3,27g\)

Bài 4 :
\(2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
0,4__________________________0,2
\(n_{KMnO4}=\frac{63,2}{158}=0,4\left(mol\right)\)
\(\Rightarrow V_{O2}=0,2.22,4=4,48\left(l\right)\)
Bài 5:
\(n_{KClO3}=\frac{24,5}{122,5}=0,2\left(mol\right)\)
\(2KClO_3\underrightarrow{^{to}}2KCl+3O_2\)
0,2_______________0,3__(mol)
\(n_{KMnO4}=\frac{24,5}{158}=0,155\left(mol\right)\)
\(2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
0,155_________________________0,078__(mol)
\(\Rightarrow V_{O2}=0,078.22,4=1,75\left(l\right)\)
Vậy khi dùng lượng KMnO4 và KClO3 như nhau thì KClO3 điều chế được nhiều O2 hơn

a. PTHH: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
b. \(n_{O_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\)
Theo PT ta có: \(n_{KMnO_4}=2.n_{O_2}=2.1,5=3\left(mol\right)\)
=> Khối lượng kali pemanganat cần lấy để điều chế 33,6 lít khí oxi là:
\(m_{KMnO_4}=3.158=474\left(g\right)\)
a)PTHH:
2KMnO4\(\underrightarrow{t^o}\)K2MnO4+ MnO+ O2
b)nO2=\(\frac{33,6}{22,4}=1,5\left(mol\right)\)
=> nKMnO4= 2.1,5=3(mol)
=>mKMnO4= 3.(39+55+16.4)= 474(g)

4.
nO2 = 1,5 mol
2KMnO4 → K2MnO4 + MnO2 + O2
⇒ mKMnO4 = 3.158 = 474 (g)
2.
2HgO → 2Hg + O2
⇒ phản ứng phân hủy
nHgO = 0,1 mol
⇒ mHg = 0,1.201 = 20,1 (g)
⇒ VO2 = 0,05.22,4 = 1,12 (l)

a) Phương trình hóa học của phản ứng:
3Fe + 2O2 → Fe3O4.
nFe3O4 = 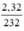 = 0,01 mol.
= 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.

a.\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
2 2 3 ( mol )
0,1 0,15
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
b.\(V_{kk}=V_{O_2}.5=3,36.5=16,8l\)
c.\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{28}{56}=0,5mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
3 2 1 ( mol )
0,5 > 0,15 ( mol )
0,225 0,15 ( mol )
\(m_{Fe\left(du\right)}=n_{Fe\left(du\right)}.M_{Fe}=\left(0,5-0,225\right).56=15,4g\)

gọi a là khối lương 2 chất
2KMnO4 => MnO2+ O2+ K2MnO4
nKMnO4=\(\frac{a}{142}\)-> nO2=\(\frac{a}{245}\)
2KClO3=> 3O2+2KCl
nKClO3=\(\frac{a}{122,5}\)-> nO2=\(\frac{a}{\frac{611}{3}}\)
ta sa sánh : \(\frac{a}{245}< \frac{a}{\frac{611}{3}}\)
=> KClO3 cho nhiều O2 hơn

1.
\(2KClO_3\underrightarrow{^{to}}2KCl+3O_2\)
\(n_{KClO3}=\frac{9,8}{122,5}=0,08\left(mol\right)\)
\(\Rightarrow n_{O2}=\frac{3}{2}n_{KClO3}=\frac{3}{2}.0,08=0,12\left(mol\right)\)
\(\Rightarrow V_{O2}=0,12.22,4=2,688\left(l\right)\)
2.
\(a,2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
\(b,n_{O2}=\frac{33,6}{22,4}=1,5\left(mol\right)\)
\(\Rightarrow n_{KMnO4}=2n_{O2}=2.1,5=3\left(mol\right)\)
\(\Rightarrow m_{KMnO4}=3.158=474\left(g\right)\)
3.
\(2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
1____________________________0,5
\(2KClO_3\underrightarrow{^{to}}2KCl+3O_2\left(1\right)\)
1____________________1,5
Đặt \(n_{KMnO4}=n_{KClO3}=1\left(mol\right)\)
\(V_{O2\left(1\right)}=0,5.22,4=11,2\left(l\right)\)
\(V_{O2\left(2\right)}=1,5.22,4=33,6\left(l\right)\)
Vậy nung KClO3 sẽ cho thể tích oxi nhiều hơn.
1___________0,5 là gì vậy bạn