Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl -->ZnCl2 + H2
____0,2<----------------------0,2
=> mZn = 0,2.65 = 13 (g)
mCu = mrắn không tan = 19,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{13}{13+19,5}.100\%=40\%\\\%Cu=\dfrac{19,5}{13+19,5}.100\%=60\%\end{matrix}\right.\)
`n_(H_2)=4,48/22,4=0,2 (mol)`
Ta có PTHH: `Zn+2HCl --> ZnCl_2 +H_2`
Theo PT: `1`--------------------------------`1`
Theo đề: `0,2`------------------------------`0,2`
`m_(Zn)=0,2.65=13(g)`
Vì `Cu` không phản ứng với `HCl` nên `m_(chất rắn không tan)=m_(Cu)=19,5(gam)`
`%Zn=13/(13+19,5) .100%=40%`
`%Cu=100%-40%=60%`

a. PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
Cu + H2SO4 ---x--->
b. Theo PT: \(n_{Al}=\dfrac{2}{3}.n_{H_2}=\dfrac{2}{3}.\dfrac{6,72}{22,4}=0,2\left(mol\right)\)
=> \(m_{Al}=0,2.27=5,4\left(g\right)\)
=> \(m_{Cu}=10-5,4=4,6\left(g\right)\)
c. \(\%_{m_{Al}}=\dfrac{5,4}{10}.100\%=54\%\)
\(\%_{m_{Cu}}=100\%-54\%=46\%\)
d. Theo PT: \(n_{H_2SO_4}=n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> \(m_{H_2SO_4}=0,3.98=29,4\left(g\right)\)
Ta có: \(C_{\%_{H_2SO_4}}=\dfrac{29,4}{m_{dd_{H_2SO_4}}}.100\%=20\%\)
=> \(m_{dd_{H_2SO_4}}=147\left(g\right)\)

\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : \(2Na+2H_2O\rightarrow2NaOH+H_2|\)
2 2 2 1
a 0,5a
\(2K+2H_2O\rightarrow2KOH+H_2|\)
2 2 2 1
b 0,5b
b) Gọi a là số mol của Na
b là số mol của K
\(m_{Na}+m_K=10,1\left(g\right)\)
⇒ \(n_{Na}.M_{Na}+n_K.M_K=10,1g\)
⇒ 23a + 39b = 10,1g (1)
Theo phương trình : 0,5a + 0,5b = 0,15(2)
Từ(1),(2), ta có hệ phương trình :
23a + 39b = 10,1g
0,5a + 0,5b = 0,15
⇒ \(\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(m_{Na}=0,1.23=2,3\left(g\right)\)
\(m_K=0,2.39=7,8\left(g\right)\)
0/0Na = \(\dfrac{2,3.100}{10,1}=22,77\)0/0
0/0K = \(\dfrac{7,8.100}{10,1}=77,23\)0/0

a)
2Al + 6HCl → 2AlCl3 + 3H2↑
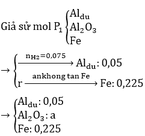
Pt: 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Giả sử P2 = kP1
=> a=0.1
=> m = 128,8g
b)
2yAl + 3FexOy → yAl2O3 + 3xFe
0,1 0,225
=> 0,225y = 0,3x => 3y = 4x
=> Fe3O4

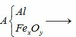
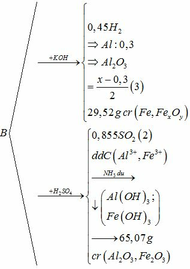
Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)
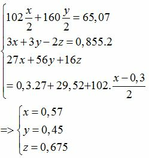
=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb
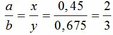
=> Fe2O3

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
b) Ta có: \(\Sigma n_{H_2}=\dfrac{3,024}{22,4}=0,135\left(mol\right)\)
Gọi số mol của Fe là \(a\) \(\Rightarrow n_{H_2\left(1\right)}=a\)
Gọi số mol của Al là \(b\) \(\Rightarrow n_{H_2\left(2\right)}=\dfrac{3}{2}b\)
Ta lập được hệ phương trình:
\(\left\{{}\begin{matrix}a+\dfrac{3}{2}b=0,135\\56b+27b=4,14\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,045\\b=0,06\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,045\cdot56=2,52\left(g\right)\\m_{Al}=1,62\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{2,52}{4,14}\cdot100\%\approx60,87\%\\\%m_{Al}=39,13\%\end{matrix}\right.\)
c) PTHH: \(FeCl_2+2NaOH\rightarrow2NaCl+Fe\left(OH\right)_2\downarrow\)
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\)
\(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
Theo các PTHH: \(\left\{{}\begin{matrix}n_{Fe\left(OH\right)_2}=n_{FeCl_2}=0,045mol\\n_{Al\left(OH\right)_3}=n_{AlCl_3}=0,06mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe_2O_3}=0,0225mol\\n_{Al_2O_3}=0,03mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe_2O_3}=0,0225\cdot160=3,6\left(g\right)\\m_{Al_2O_3}=0,03\cdot102=3,06\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{chấtrắn}=3,06+3,6=6,66\left(g\right)\)

1.
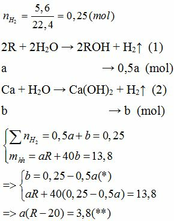
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
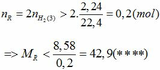
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
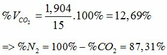
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
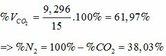

Câu 1