Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
Cation X 2 + có số hạt proton là X, số hạt nơtron là N và số electron là (Z-2)
Ta có 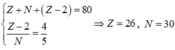
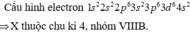

Đáp án A
Theo giả thiết ta có
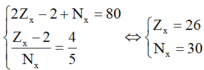
⇒ X là Fe
Ta có cấu hình của Fe là: 1s22s22p63s23p63d64s2 từ cấu hình
=> Fe thuộc chu kì 4 và nhóm VIIIB

Đáp án A
Theo giả thiết ta có
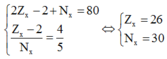
=> X là Fe
Ta có cấu hình của Fe là: 1s22s22p63s23p63d64s2 từ cấu hình Fe thuộc chu kì 4 và nhóm VIIIB.

Cation r3+ có TSH =37 nên ta có pt
2p+n-3=37 (1) ( p=e, thay vì p+n+e-3 thì ghi lại là 2p + n-3=37)
Tỉ số hạt e đối với n là 5/7 =>
(p-3)/n = 5/7 <=> 5n = 7(p-3) <=> 7p -5n =21 (2) ( p=e nên thay e bằng p)
Ghép (1) (2) ta được hệ phương trình, giải hệ ta có
R gồm p=e=13 , n=14
nên R3+ gồm p=13, e=10, n=14

Đáp án D
Cấu hình electron ở phân lớp ngoài cùng của R3+ ( ở trạng thái cơ bản) là 2p6
→ Cấu hình electron của R là 1s22s22p63s23p1
→ R có p = e =13
→ tổng số hạt mang điện trong nguyên tử R là : p+e= 13+13=26

\(\left\{{}\begin{matrix}P+N+E=115\\P=E\\N-P=10\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2P+N=115\\N-P=10\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P=E=35\\N=45\end{matrix}\right.\\ \Rightarrow A=P+N=35+45=80\left(đ.v.C\right)\)