Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C+O2-to>CO2
1,5--1,5 -----1,5mol
n C=\(\dfrac{18}{12}\)=1,5 mol
=>Vkk=1,5.22,4.5=168l
=>VCO2=1,5.22,4=33,6l
nC = 18/12 = 1,5 (mol)
PTHH: C + O2 -> (t°) CO2
Mol: 1,5 ---> 1,5 ---> 1,5
VO2 = 1,5 . 22,4 = 33,6 (l)
Vkk = 33,6 . 5 = 168 (l)
VCO2 = 1,5 . 22,4 = 33,6 (l)

a) C + O2 --to--> CO2
b) \(n_C=\dfrac{24}{12}=2\left(mol\right)\)
=> nCO2 =2 (mol)
=> mCO2 = 2.44 = 88(g)
c)
nO2 = 2(mol)
=> VO2 = 2.22,4 = 44,8 (l)
=> Vkk = 44,8.5=224(l)

\(n_C=\dfrac{1.2}{12}=0.1\left(mol\right)\)
\(C+O_2\underrightarrow{^{^{t^0}}}CO_2\)
\(0.1.....0.1\)
\(V_{O_2}=0.1\cdot22.4=2.24\left(l\right)\)
nC=1,2/12=0,1(mol)
PTHH:C + O2 -to-> CO2
0,1________0,1____0,1
V(O2,đktc)=0,1 x 22,4=2,24(l)

a) Theo phương trình hóa học, ta thấy nếu đốt cháy hết 1 mol phân tử khí CH4 thì phải cần 2 mol phân tử khí O2. Do đó thể tích khí oxi cần dùng để đốt cháy hoàn toàn 2 lít khí metan là:
VO2 = 2 . 2 = 4 lít.
b) Theo phương trình phản ứng, khi đốt cháy hoàn toàn 0,15 mol khí metan thì cũng sinh ra 0,15 mol khí cacbon đioxit. Do đó thể tích khí CO2 thu được là:
VCO2 = 0,15 . 22,4 = 3,36 lít.
c) Tỉ khối của khí metan và không khí là:
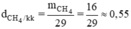
Vậy khí metan nhẹ hơn không khí 0,55.

a, nO2 = 5,6/22,4 = 0,25 (mol)
PTHH: C + O2 -> (t°) CO3
Mol: 0,25 <--- 0,25 ---> 0,25
b, mCO2 = 0,25 . 44 = 11 (g)
c, LTL: 0,2 < 0,25 => O2 dư

\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{22,4:5}{22,4}=0,2mol\)
\(n_S=\dfrac{m_S}{M_S}=\dfrac{3,2}{32}=0,1mol\)
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
0,1< 0,2 ( mol )
0,1 0,1 9 mol )
\(m_{SO_2}=n_{SO_2}.M_{SO_2}=0,1.64=6,4g\)

\(n_C=\dfrac{14,4}{44}=\dfrac{18}{55}\left(mol\right)\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ n_{O_2}=n_C=n_{CO_2}=\dfrac{18}{55}\left(mol\right)\\ a,V_{O_2\left(đktc\right)}=\dfrac{18}{55}.22,4=\dfrac{2016}{275}\left(lít\right)\\ b,V_{kk}=\dfrac{100}{21}.\dfrac{2016}{275}=\dfrac{381}{11}\left(lít\right)\\ c,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ n_{KClO_3\left(LT\right)}=\dfrac{2}{3}.n_{O_2}=\dfrac{2}{3}.\dfrac{18}{55}=\dfrac{12}{55}\left(mol\right)\\ \Rightarrow n_{KClO_3\left(TT\right)}=120\%.\dfrac{12}{55}=\dfrac{72}{275}\left(mol\right)\\ \Rightarrow m_{KClO_3}=122,5.\dfrac{72}{275}=\dfrac{1764}{55}\left(g\right)\)
\(n_C=0,5\left(mol\right)\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ n_{O_2}=n_C=0,5\left(mol\right)\\ \Rightarrow V_{O_2\left(đktc\right)}=0,5.22,4=11,2\left(l\right)\\ Mà:V_{O_2}=\dfrac{1}{5}V_{kk}\Leftrightarrow V_{kk}=5.V_{O_2}=5.11,2=56\left(lít\right)\)