Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2K+2H2O->2KOH+H2
0,45---0,45-----0,45---0,225
n K=0,5 mol
n H2O=0,45 mol
=>K dư
=>m KOH=0,45.56=25,2g
=>VH2=0,225.22,4=5,04l
\(n_K=\dfrac{m}{M}=\dfrac{19,5}{39}=0,5\left(mol\right)\)
\(a,2K+2H_2O\rightarrow2KOH+H_2\uparrow\)
\(2\) \(:\) \(2\) \(:\) \(2\) \(:\) \(1\)
\(0,5\) \(0,5\) \(0,5\) \(0,25\) \(\left(mol\right)\)
\(b,m_{KOH}=n.M=0,5.56=28\left(g\right)\)
\(c,V_{H_2}=n.22,4=0,25.22,4=11,2\left(l\right)\)

\(n_K=\dfrac{7,8}{39}=0,2\left(mol\right)\\ a,2K+2H_2O\rightarrow2KOH+H_2\uparrow\\ n_{H_2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ V_{H_2\left(\text{đ}ktc\right)}=0,1.22,4=2,24\left(l\right)\\ b,n_{KOH}=n_K=0,2\left(mol\right)\\ m_{KOH}=0,2.56=11,2\left(g\right)\\ c,m_{\text{dd}sau}=m_K+m_{H_2O}-m_{H_2}\)
Nhưng chưa có KL nước?

\(n_K=\dfrac{3,9}{39}=0,1mol\)
\(2K+2H_2O\rightarrow2KOH+H_2\)
0,1 0,1 0,05 ( mol )
\(m_{KOH}=0,1.56=5,6g\)
\(V_{H_2}=0,05.22,4=1,12l\)

a, \(2K+2H_2O\rightarrow2KOH+H_2\)
b, \(n_K=\dfrac{3,9}{39}=0,1\left(mol\right)\)
Theo PT: \(n_{KOH}=n_K=0,1\left(mol\right)\Rightarrow m_{KOH}=0,1.56=5,6\left(g\right)\)
\(n_K=\dfrac{m}{M}=\dfrac{3,9}{39}=0,1\left(mol\right)\\ PTHH:2K+2H_2O->2KOH+H_2\)
tỉ lệ 2 : 2 : 2 ; 1
n(mol) 0,1---.0,1------>0,1------>0,05
\(m_{KOH}=n\cdot M=0,1\cdot\left(39+16+1\right)=5,6\left(g\right)\)

Số mol của kali
nk=13,65:39= 0,35(mol)
pt: 2K + 2H2O➝ 2KOH + H2\(]\)
2 2 2 2
0,35 0,35 0,35
b) Số mol của khí hidro
nH2= \(\dfrac{0,35.2}{2}=0,35\)(mol)
Thể tích khí hidro ở dktc
VH2=0,35.22,4=7,84(lit)
Số mol của kali hidroxit
NKOH=\(\dfrac{0,35.2}{2}=0,35\) (mol)
Khối lượng của kali hidroxit
mKOH=0,35.56=19,6(g)
Chúc bạn học tốt

2Na+2H2O->2NaOH+H2
x-------------------x---------0,5x
2K+2H2O->2KOH+H2
y-----------------y-----------0,5y
nH2O=2n H2
=>mH2O=\(\dfrac{4,48}{22,4}2.18\)=7,2g
Ta có :\(\left\{{}\begin{matrix}23x+39y=11,6\\0,5x+0,5y=0,2\end{matrix}\right.\)
=>x=0,25 mol, y=0,15 mol
=>m bazo=0,25.40+0,15.56=18,4g
d) m Na=0,25.23=5,75g
=>m K=0,15.39=5,85g
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
gọi nNa :a , nk :b (a,b>0)
=> 23a+39b=11,6(g)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
a \(\dfrac{1}{2}a\)
\(2K+2H_2O\rightarrow2KOH+H_2\)
b \(\dfrac{1}{2}b\)
=> \(\left\{{}\begin{matrix}23a+39b=11,6\\\dfrac{1}{2}a+\dfrac{1}{2}b=0,2\end{matrix}\right.\)
=> a= 0,25 , b = 0,15(mol)
theo pt nH2O = 0,4+0,4=0,8(mol)
=> mH2O = 0,8.18=14,4(g)
theo pthh : nKOH = 0,15 , nNaOH = 0,25
=> \(\left\{{}\begin{matrix}m_{KOH}=0,15.56=8,4\left(g\right)\\m_{NaOH}=0,25.40=10\left(g\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}m_K=0,15.39=5,85\left(g\right)\\m_{Na}=0,25.23=5,75\left(g\right)\end{matrix}\right.\)
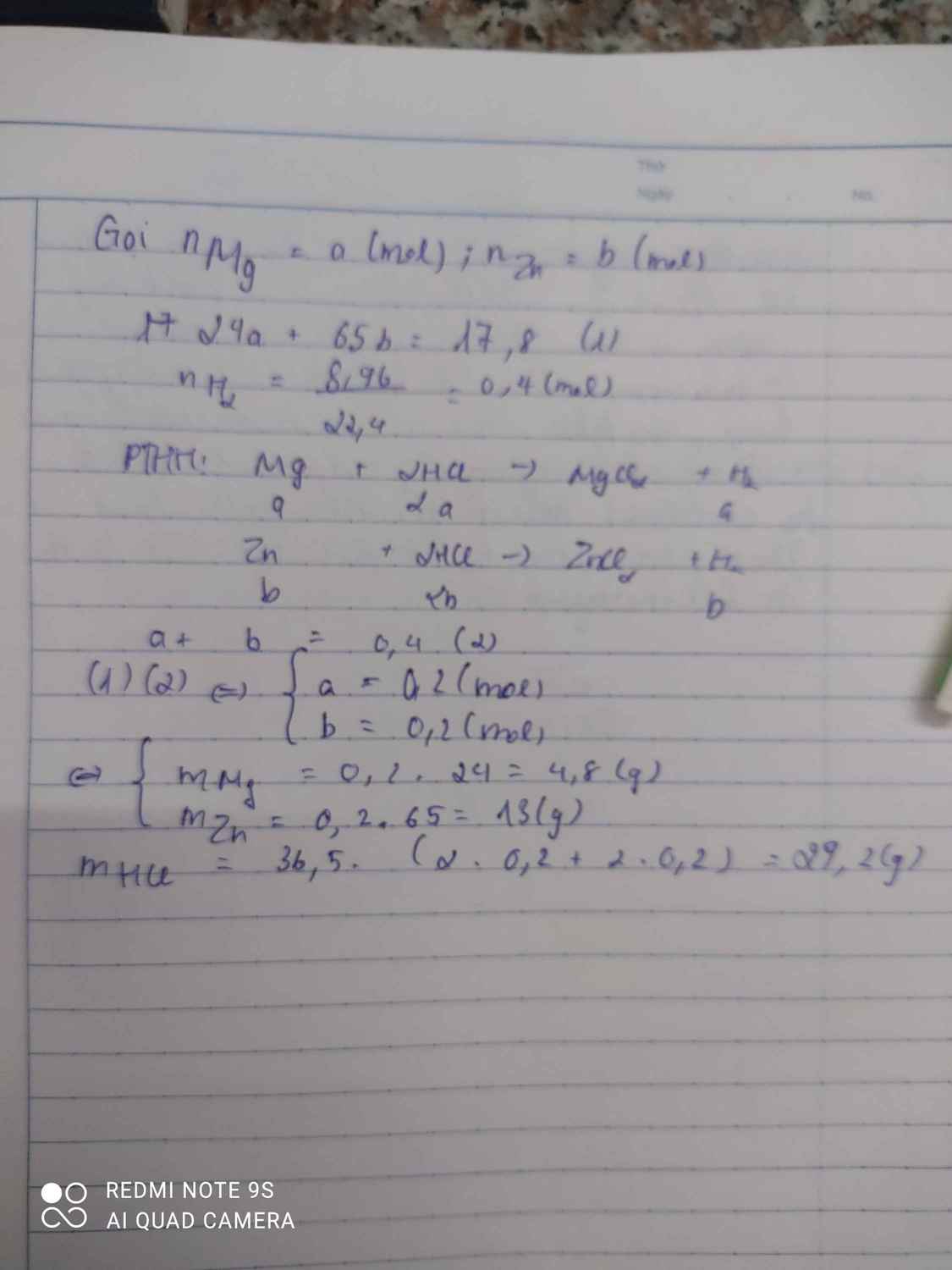
nH2=8,96:22,4=0,4
2K + 2H2O----> 2KOH + H2
2mol-------------->2 mol--->1mol
?------------------>?---------->0,4mol
nK=0,4.2:1=0,6(mol)
nKOH=0,4.2:1=0,6(mol)
mk=0,6.39=23,4(g)
mKOH=0,6.56=33,6(g)