Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho các chất sau: Cl2, H2SO4, Cu(NO3)2. Phân tử khối lần lượt là: (Biết: Cl=35,5, H=1, S=32, Cu=64, N=14, O=16)
A. 71 đvC; 188 đvC; 98 đvC.
B. 71đvC; 98 đvC; 188 đvC.
C. 98 đvC; 71 đvC; 188 đvC.
D. 188 đvC; 98 đvC; 71 đvC.

a II
CTHH: X2O3 : Gọi a là hoá trị của X.
=> a . 2 = II . 3
=> a = \(\frac{II\times3}{2}=\left(III\right)\)
I b
CTHH: HY : Gọi b là hoá trị của Y.
=> I . 1 = b . 1
=> b = \(\frac{I\times1}{1}=\left(I\right)\)
III I
CTHH chung: XxYy
=> III . x = I . y
=> \(\frac{x}{y}=\frac{I}{III}=\frac{1}{3}\)
=> x = 1 , y = 3
CTHH: XY3

a. PTK của hợp chất nặng hơn phân tử hidro 31 lần
Phân tử khối của phân tử hidro là 1.2 = 2 đvC
⇒ Phân tử khối của hợp chất là: 2.31 = 62 đvC
b. PTK hợp chất = 2.NTK X + 1.NTK O = 62 đvC
⇒ 2.NTK X + 16 = 62 đvC
Vậy nguyên tử khối của X là 23. Nguyên tố X là natri (Na)
bỏ chữ
b. PTK hợp chất = 2.NTK X + 1.NTK O = 62 đvC
⇒ 2.NTK X + 16 = 62 đvC
bạn viết là 2X+1O = 62 đvC cũng đủ hiểu mà ![]()

\(PTK_{hc}=2.NTK_R+5.NTK_O\\ \Leftrightarrow71.2=NTK_R+5.16\\ \Leftrightarrow NTK_R=31\left(đ.v.C\right)\\ \Rightarrow R:Photpho\left(NTK_P=31\left(đ.v.C\right)\right)\\ \)

Ta có :
PTKCa = 40 (đvC)
=> PTKhợp chất A = 40(đvC)
Do trong hợp chất A có chứa 60% Mg(1)
=> Khối lượng của Mg trong hợp chất A là :
40 * 60% = 24 (đvC)
Mà NTKMg = 24 đvC => có 1 nguyên tử Mg trong hợp chất A(*)
Tù (1) => % của Oxi trong hợp chất A là :
100% - 60% = 40%
=> Khối lượng của Oxi trong hợp chất A là :
40 * 40% = 16 (đvC)
Mà NTKO = 16 đvC => có 1 nguyên tử O trong hợp chất A (**)
Từ (*) và (**) => công thức hóa học của hợp chất A là :
CuO
%mO = 100%-60%=40%
Công thức chung của h/c : MgxOy
Ta có : x : y = \(\frac{60\%}{24}:\frac{40\%}{16}\)=2,5 : 2,5 = 1 : 1
=> CTHH h/c A : MgO
Ta có : MA=MCa=40 g/mol
Mà MMgO= 24 + 16 = 40
=> CTHH : MgO
( Mấy bài dạng này làm lâu rồi nên mình cũng quên cách làm mất không biết đúng không bạn cứ tham khảo )

Hợp chất Ba(NO3)x có phân tử khối là 261 đvC. Tìm CTPT và hoá trị của Ba trong hợp chất này biết hoá trị của nhóm NO3 là I.
\(M_{Ba\left(NO_3\right)_x}=137+62.x=261\)
=> x=2
=> CTPT : Ba(NO3)2
Vậy hóa trị của Ba là II
Hợp chất N2Oz có phân tử khối là 44 đvC. Tìm chỉ số z và hoá trị của N trong hợp chất này.
\(M_{N_2O_z}=14.2+16z=44\)
=> z=1
=> N2O
Áp dụng QT hóa trị => Hóa trị của N trong hợp chất là \(\dfrac{2.1}{2}=1\)
Một hợp chất sắt hidroxit trong phân tử có 1 Fe liên kết với một số nhóm OH. Biết phân tử khối của hợp chất này bằng 107 đvC. Hãy xác định hoá trị của Fe trong hợp chất đó.
CT của hidroxit : Fe(OH)x (x là hóa trị của Fe)
\(M_{Fe\left(OH\right)_x}=56+17.x=107\)
=> x=3
Vậy hóa trị của Fe trong hợp chất là Fe(OH)3
Một oxit kim loại có công thức là MxOy có phân tử khối bằng 102 đvC. Biết M có hoá trị III. Hỏi M là kim loại nào?
Vì M hóa trị III
=>CT oxit có dạng M2O3
Ta có : \(M_{M_2O_3}=2M+16.3=102\)
=> M=27
Vậy M là Nhôm (Al)
Hợp chất M(NO3)y có phân tử khối là 242 đvC. Biết M có hoá trị III và axit tương ứng của gốc NO3 là HNO3. Hãy xác định kim loại M.
Vì M hóa trị III nên CT của hợp chất là M(NO3)3
Ta có : \(M_{M\left(NO_3\right)_3}=M+62.3=242\)
=> M=56
Vậy M là Sắt (Fe)
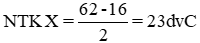
PTK của Ca(NO3)2 = 40+(14+16.3).2=164 đvC