Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Br_2}=0,2.0,1=0,02\left(mol\right)\\ n_{HC}:n_{Br_2}=0,01:0,02=1:2\\ \Rightarrow X:C_2H_2\left(Ankin\right)\\ Chọn.B\)

Gọi công thức của ba hiđrocacbon đó là : C x H y , C a H b , C n H m
Khi đốt ta có :
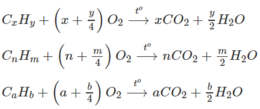
Vì số mol CO 2 tạo ra bằng 2 lần số mol hiđrocacbon đem đốt. Vậy theo phương trình hoá học của phản ứng cháy
→ X = a = n = 2.
Mặt khác : A không làm mất màu nước brom → không có liên kết đôi hoặc ba. Vậy A là CH 3 - CH 3
1 mol B chỉ tác dụng tối đa với 1 mol brom → có 1 liên kết đôi.
Vậy B là CH 2 = CH 2
1 mol C tác dụng tối đa với 2 mol brom → có liên kết ba.
Vậy C là CH ≡CH.

PTHH: \(CH_3-CH_2-C\equiv CH+2Br_2\rightarrow CH_3-CH_2-CBr_2-CHBr_2\)
0,2------------>0,4
=> \(m_{Br_2}=0,4.160=64\left(g\right)\)
PTHH:
\(CH_3-CH_2-C\equiv CH+2Br-Br\rightarrow CH_3-CH_2-CH_2-CHBr_2\)
0,2------------------------------->0,4
=> Mất màu tối đa 0,4 mol Br2

\(n_{Br_2}=0,1.0,1=0,01\left(mol\right)=n_X\)
Vậy \(X\)là hidrocacbon không no, tác dụng với \(Br_2\) theo tỉ lệ \(1\div1\)nên \(X\) là anken.

Lời giải:
CH2=CH2 + Br2 → C2H4Br2 (1)
P.ư: →
(mol)
HC=CH + 2Br2 → Br2CH-CHBr2 (2)
P.ư: → 2.
(mol)
Từ (1) và (2) ta thấy số mol Br2 phản ứng với C2H2 gấp 2 lần số mol Br2 phản ứng với C2H4
Vì cùng một dung dịch brom nên thể tích dung dịch brom cần là 50 x 2 = l00ml.
Giải:
Ta có:\(n_{C_2H_4}=\dfrac{0.1}{22,4}=\dfrac{1}{224}\left(mol\right)\)
\(C_2H_4\) + Br2 → C2H4Br2 (1)
\(\dfrac{1}{224}mol:\dfrac{1}{224}mol\) \(C_2H_2\) + 2Br2 → \(C_2H_2Br_4\) (2) \(\dfrac{1}{224}mol:\dfrac{2}{224}mol\) Từ (1)(2):ta thấysố mol Br2 phản ứng với C2H2 gấp 2 lần số mol Br2 phản ứng với C2H4
Vì cùng một dung dịch brom nên thể tích dung dịch brom cần là 50 x 2 = 100ml.