Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Kim loại cần tìm đặt là A.
=> CTHH oxit: A2O3
\(A_2O_3+H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2O\\ m_{ddsau}=10,2+331,8=342\left(g\right)\\ m_{A_2\left(SO_4\right)_3}=\dfrac{342}{100}.10=34,2\left(g\right)\\ n_{oxit}=\dfrac{34,2-10,2}{96.3-16.3}=0,1\left(mol\right)\\ M_{A_2O_3}=\dfrac{10,2}{0,1}=102\left(\dfrac{g}{mol}\right)=2M_A+48\left(\dfrac{g}{mol}\right)\\ \Rightarrow M_A=\dfrac{102-48}{2}=27\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Nhôm\left(Al=27\right)\\ \Rightarrow CTHH.oxit:Al_2O_3\)

Gọi CT của oxit : RO
n RO = a ( mol )
PTHH:
RO + H2SO4 ====> RSO4 + H2O
a--------a------------------a
theo pthh:
n H2SO4 = n RSO4 = n RO = a ( mol )
Có: n H2SO4=a ( mol ) => m H2SO4 = 98a ( g )
=> m dd H2SO4 20% = 490a ( g )
BTKL: m dd sau phản ứng = a ( R + 16 ) + 490a = aR + 506a ( g )
Lại có :
n RSO4 = a ( mol ) => m RSO4 = aR + 96a
=> \(\dfrac{aR+96a}{aR+506a}=\dfrac{22,64}{100}\Rightarrow\dfrac{a\left(R+96\right)}{a\left(R+506\right)}=\dfrac{22,64}{100}\)
\(\Rightarrow R=24\left(Mg\right)\)
Vậy CT: MgO

a, PT: \(R_2O_3+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(m_{H_2SO_4}=168.35\%=58,8\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{58,8}{98}=0,6\left(mol\right)\)
Theo PT: \(n_{R_2O_3}=\dfrac{1}{3}n_{H_2SO_4}=0,2\left(mol\right)\)
\(\Rightarrow M_{R_2O_3}=\dfrac{32}{0,2}=160=2M_R+16.3\Rightarrow M_R=56\left(g/mol\right)\)
→ R là Fe.
b, Ta có: m dd sau pư = mFe2O3 + m dd H2SO4 = 32 + 168 = 200 (g)
Ta có: \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,2\left(mol\right)\)
\(\Rightarrow C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,2.400}{200}.100\%=40\%\)
c, Ta có: \(n_{Fe_2\left(SO_4\right)_3.10H_2O}=n_{Fe_2\left(SO_4\right)_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe_2\left(SO_4\right)_3.10H_2O}=0,2.580=116\left(g\right)\)

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
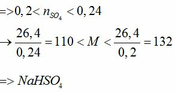
b)
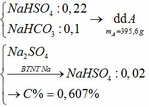
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

Phân tử khối của mỗi chất là: M = 1,875.32 = 60
Gọi CTPT là CxHyOz
+ z = 1: 12x + y = 44
Do 0 < H ≤ 2C + 2 => 0 < y ≤ 2x+2 => 0 < 44-12x ≤ 2x+2 => 3 ≤ x < 3,67 => x = 3
CTPT là C3H8O
+ z = 2: 12x + y = 28
Do 0 < H ≤ 2C + 2 => 0 < y ≤ 2x+2 => 0 < 28-12x ≤ 2x+2 => 1,857 ≤ x < 2,33 => x = 2
CTPT là C2H4O2
- Do X, Y, Z đều có khả năng phản ứng với Na nên có chứa nhóm –OH hoặc –COOH.
- Y tác dụng với dung dịch NaHCO3 nên Y là hợp chất axit. Công thức phân tử của Y là C2H4O2. Công thức cấu tạo của Y là CH3COOH.
- Khi oxi hóa X tạo X1 có khả năng tham gia phản ứng tráng gương nên X là ancol bậc 1. Công thức phân tử của X là C3H8O. Công thức cấu tạo của X là: CH3-CH2-CH2-OH.
- Chất Z có khả năng tham gia phản ứng tráng gương nên Z có chứa nhóm chức –CHO. Công thức phân tử của Z là C2H4O2. Công thức cấu tạo của Z là HO-CH2-CHO.
Chú ý:
+ Tác dụng với Na thì trong phân tử có nhóm – OH hoặc –COOH
+ Có phản ứng tráng bạc => trong phân tử có nhóm –CHO

Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu
Bài 1 :Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu

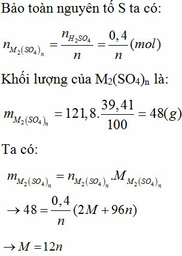

Bài tập 7: Hòa tan hoàn toàn 20,4 gam oxit kim loại R hóa trị (III) trong 300 ml dung dịch H2SO4, sau khi phản ứng hoàn toàn thu được 68,4 gam muối khan.
a/ Xác định công thức hóa học của oxit kim loại R.
b/ Tính nồng độ mol của dung dịch H2SO4 đã dùng.
-------
a) - Gọi oxit của kim loại R(III) cần tìm là R2O3 .
PTHH: R2O3 + 3 H2SO4 -> R2(SO4)3 + 3 H2O
Theo PTHH: 2MR + 48 (g) ______2MR + 288(g)
Theo đề: 20,4(g)______________68,4(g)
Theo PTHH và đề bài ta có:
\(68,4.\left(2M_R+48\right)=20,4.\left(2M_R+288\right)\)
<=> 136,8MR +3283,2 = 40,8 MR + 5875,2
<=> 136,8 MR - 40,8 MR = 5875,2 - 3283,2
<=>96MR = 2592
=> MR = 2592/96 = 27(g/mol)
=> Kim loại R(III) là nhôm (Al=27)
=> Oxit cần tìm là nhôm oxit (Al2O3)
b) nAl2O3= 20,4/102= 0,2(mol)
=> nH2SO4 = 3.0,2= 0,6(mol)
VddH2SO4= 300(ml)= 0,3(l)
=> \(C_{MddH2SO4}=\dfrac{0,6}{0,3}=2\left(M\right)\)
Bài tập 14: Người ta khử 29 gam sắt từ oxit bằng khí cacbon oxit ở nhiệt độ cao. Tính khối lượng sắt thu được sau phản ứng, biết hiệu suất của phản ứng là 80%.
-------
Giaỉ:
PTHH: Fe3O4 +4 CO -to-> 3 Fe + 4 CO2
nFe2O3= 29/232= 0,125(mol)
=> nFe(lí thuyết)= 3. 0,125 = 0,375(mol)
Vì: H= 80%. Nên:
nFe(thực tế)= 0,375. 80%= 0,3(mol)
=>mFe(thực tế)= 0,3.56= 16,8(g)