Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
SO2 + Br2 + 2H2O =.> 2HBr + H2SO4
SO2 đã khử Br2 có màu thành HBr không màu
Khi dẫn khí SO2 vào dung dịch axit H2S dung dịch bị vẩn đục màu vàng:
SO2 + 2H2S = 3S + 2H2O , SO2 đã oxi hóa H2S thành S
b)Khi cho clo vào nước thì: Cl2 + H2O --> HCl + HClO.
Khi cho flo vào nước thì flo do là chất oxi hóa mạnh sẽ bốc cháy trong nước nên không thể điều chế được nước clo:
2F2 + 2H2O --> 4HF + O2
c)dùng dd KI có lẫn hồ tinh bột
2KI + H20 +O3--->2 KOH +I2 + O2
a. + Cho SO2 vào dd Br2:
Ptpu: SO2 + Br2 + 2H2O \(\rightarrow\) H2SO4 + 2HBr
(chất khử)
Htg: dd Br2 bị mất màu
+ Cho SO2 vào dd H2S
Ptpu: SO2 + 2H2S \(\rightarrow\) 3S\(\downarrow\) + 2H2O
(chất oxi hóa)
Htg: dd bị vẩn đục màu vàng
b. + Điều chế được nước clo vì clo tan nhiều trong nước nhưng chỉ một phần khí clo tác dụng với nước theo ptpu:
Cl2 + H2O\(\leftrightarrow\) HCl + HClO
+ Còn Flo tan trong nước thì oxi hóa hoàn toàn nước ngay ở nhiệt độ thường theo ptpu:
4F2 + 4H2O \(\rightarrow\) 4HF + O2
Do đó F2 không thể tồn tại trong nước
c. Cho quỳ tím td với ozon và oxi, ta thấy khi quỳ tím td với ozon thì quỳ tím hóa xanh, còn oxi ko pư
pthh:
\(O_3+2KI+H_2O\rightarrow I_2+2KOH+O_2\) (oxi không có)
Do tạo ra KOH nên O3 làm xanh quỳ tím ẩm dd KI
\(2Ag+O_3\rightarrow Ag_2O+O_2\) ( oxi không có pư)

a) Hiện tượng : Mg tan dần , có khí không màu thoát ra
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
b) Hiện tượng : tạo kết tủa trắng
\(HCl+AgNO_3\rightarrow HNO_3+AgCl\downarrow\)
c) Hiện tượng : quỳ tím chuyển sang màu đỏ , sau đó bị mất màu
d) Hiện tượng : Dung dịch có màu nâu , có khí màu đỏ nâu thoát ra
\(Cl_2+BaBr_2\rightarrow BaCl_2+Br_2\)
Chúc bạn học tốt

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Dung dịch muối Magie clorua thu được có màu xanh lục , tinh thể thì có màu đỏ nhạt
\(b,AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)
Kết tủa thu được có màu trắng bạc .
c, \(Cl_2+H_2O\rightarrow HCl+HClO\)
Mẫu quỳ tìm chuyển sang màu đỏ do có 2 axit tạo thành nhưng dần mất màu vì HClO có tính oxi hóa mạnh , diệt khuẩn , tẩy màu nên một lúc sau giấy thử mất màu .
d,\(Cl_2+BaBr_2\rightarrow BaCl_2+Br_2\)
Dung dịch BaCl2 sau p/u không màu và khí Br2 thoát ra có màu nâu

Nước clo dần dần bị mất màu theo thời gian, không bảo quản được lâu là do quá trình phân huỷ HClO :
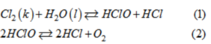
Phản ứng (2) làm cho nồng độ HClO giảm, cân bằng hoá học của phản ứng (1) chuyển dịch theo chiều thuận, clo sẽ phản ứng với nước cho đến hết, do đó nước clo không bền.

Clo đẩy brom ra khỏi muối :
Cl 2 + 2NaBr → NaCl + Br 2
Brom tan vào nước tạo ra dung dịch màu vàng.
Tiếp tục cho clo đi vào thì nó oxi hoá brom :
5 Cl 2 + Br 2 + 6 H 2 O → 2HBr O 3 + 10HCl
Các axit tạo thành không màu, dung dịch của chúng là quỳ tím hoá đỏ.

Ban đầu, giấy quỳ tím chuyển màu đỏ(do tính axit của HCl). Sau một thời gian, giấy quỳ tím mất màu(do tính oxi hóa mạnh của HClO).
\(Cl_2 + H_2O \rightleftharpoons HCl + HClO\)
Bình đựng khí clo ẩm:
Cl2 + H20 <=> HCl + HClO
Lúc đầu quỳ tím hóa đỏ vì HCl là axit
Bài 2 :
Cho giấy quỳ tím ẩm vào bình đựng khí hidroclorua thì giấy quỳ tím ẩm hóa đỏ. Do hidroclorua tan trong nước ở giấy quỳ tím nên tạo môi trường axit.
Bài 3 :
Trong bình thủy tinh có hàm lượng lớn SiO2 . Mặt khác, SiO2 tan trong dung dịch axit flohidric nên nếu đựng dung dịch flohidric sẽ làm thủng cốc.
SiO2 + 4HF → SiF4 + 2H2O
Bài 4 :
Khi đốt than, sinh ra hai loại khí là CO và CO2 :
\(C + O_2 \xrightarrow{t^o} CO_2\\ 2C + O_2 \xrightarrow{t^o} 2CO\)
CO,CO2 là hai khí độc.Do vậy,nếu đốt than trong phòng kín sẽ gây ngạt thở.
Bài 5 :
Dung dịch axit sunfuhidric để lâu ngoài không khí sẽ xuất hiện vẩn đục màu vàng do phản ứng với O2 trong không khí tạo kết tủa S(lưu huỳnh)
\(2H_2S + O_2 \to 2S + 2H_2O\)
Trong đời sống thì khí CO2 không độc, không gây cháy nổ