Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

I. Lý thuyết
1, Chất điện li: là những chất tan trong nước và nóng chảy phân li ra ion
2, Sự điện li: là quá trình phân li các chất trong nước và nóng chảy ra ion.
3, Độ điện li: a=n/n(0)
Trong đó:
n là số phân tử chất đã phân li thành ion
n(0) là tổng số phân tử hoà tan chất đó trong dung dịch.
Độ điện li anpha(a) phụ thuộc vào các yếu tố sau:
+Bản chất liên kết của chất tan.
+Dung môi, nhiệt độ, nồng độ (dung dịch càng loãng độ điện li càng tăng)
• 0<a<1: Chất điện li yếu
• a=1 : Chất điện li mạnh.
4: Hằng số phân li:
Giả sử có chất điện li yếu MA với nồng độ ban đầu C và độ điện li anpha(a)
MA<---->M(+)+A(-)
Nồng độ: (1-a)C........aC.......aC
Khi đó ta có:
K=[M+][A-]/[MA] và pK=-logK
Chú ý:
- K phụ thuộc chủ yếu vào bản chất chất điện ly, dung môi và nhiệt độ.
- Hằng số phân ly của axit kí hiệu là Ka hoặc pKa.
- Hằng số phân ly của bazo kí hiệu là Kb hoặc pKb.
- Hằng số phân ly của axit(bazo) càng lớn thì axit (bazo) càng mạnh.
- Đối với axit yếu, bazo yếu xác định, Ka và Kb chỉ còn phụ thuộc vào nhiệt độ.
5: Axit-bazo-hiđroxit lưỡng tính
a. Định nghĩa axit,bazo:
• Theo Areniuyt:
- Axit: là chất khi tan trong nước phân li cho cation H+
- Bazơ: là chất khi tan trong nước phân li cho anion OH-
- Hiđroxit lưỡng tính : là chất khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
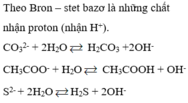
• Theo Bron-stet
- Axit: là chất có khả năng nhường proton (H+)
- Bazơ: là chất có khả năng nhận proton (H+).
- hiđroxit lưỡng tính là chất có khả năng vừa nhường vừa nhận proton (H+).
( Thuyết Bronsted không chỉ giới hạn trong dung dich nước mà còn áp dụng cho các dung dịch có dung môi khác. Thí dụ trong dung môi ammoniac lỏng:
HCl(trong NH3) + NH3(ℓ) NH4+(trong NH3) + Cl-(trong NH3)
Axit1 Baz2 Axit2 Baz1
=> Nhận xét:
- Axit Bronsted có thể là: phân tử trung hòa (H2O, HCl...), cation (H+, H3O+, NH4+...), anion (HCO3-, HS-...)
- Baz Bronsted có thể là: phân tử trung hòa (H2O, NH3...), anion (OH-, Cl-, CH3COO-...))
b.Độ mạnh của axit-bazơ:
- Ngoài độ điện li a, hằng số phân li ngưòi ta còn thường biểu thị độ mạnh của axit, bazơ bằng hằng số pH, pKa, pKb.
- pH=-log[H+] pOH=-log [OH-].
- Với dung dịch axit: [H+]>10^-7 => pH<7.
- Với dung dịch bazơ: [H+]<10^-7=>pH>7.
- pH+pOH=14
c.Hằng số phân ly của axit Ka và hằng số phân li của bazơ Kb:
- Hằng số axit= hằng số phân li= hằng số cân bằng ( với axit yếu).
- Axit càng mạnh, Ka càng lớn,pKa càng nhỏ.
- Hằng số bazơ=hằng số phân li=hằng số cân bằng của sự phân li của bazơ.
6: Phản ứng trao đổi trong dung dịch chất điện li:
a. điều kiện xảy ra phản ứng trao đổi trong dung dịch chất điện li:
- Phản ứng tạo thành chất kết tủa.
- Phản ứng tạo thành chất điện li yếu ( nứơc, ion phức, axit yếu).
- Phản ứng tạo thành chất khí .
b. Sự thuỷ phân của muối.
Phản ứng trao đổi ion giữa muối hoà tan và nước làm cho pH biến đổi được gọi là sự thuỷ phân của muối.
- Muối trung hoà tạo bởi gốc axit mạnh và gốc bazơ mạnh ( NaCl, Na2SO4, KNO3) không bị thuỷ phân vì các cation của bazơ mạnh và anion của axit mạnh đều không thể liên kết với các ion của nứơc.
- Thuỷ phân muối trung hoà tạo bởi gốc axit yếu và gốc bazơ mạnh (Na2CO3, K2S, CH3COONa..) dung dịch có tính kiềm nên pH>7.
Na2S ---> 2Na+ + S(2-)
S(2-) <----> HS(-) + OH(-).
- Thuỷ phân muối trung hoà tạo bởi gốc axit mạnh và gốc bazơ yếu (NH4Cl, FeCl3,...) dung dịch có tính axit nên pH<7
c.Thuỷ phân muối trug hoà tạo bởi gốc axit yếu và gốc bazơ yếu: (CH3COONH4, (NH4)2CO3..)
Ví dụ: CH3COONH4 ----> Nh4(+) + CH3COO(-)
NH4(+)+ CH3COO(-)+ HOH <---> CH3COOH+ NH4OH
Phương trình phản ứng cho thấy là kết quả của phản ứng thuỷ phân tạo ra axit yếu và bazơ yếu. Dung dịch có tính trung tính nếu các hằng số phân li của bazơ và axit gần như nhau. Nếu chúng khác nhau 1 vài bậc thì môi trường có thể là axit yếu hay bazơ yếu.
- Lưu ý : Khi viết phương trình phản ứng của ion có trong muối với nước bao giờ ta cũng lấy ion yếu tác dụng với nứơc.
-Những muối axit như NaHCO3, KH2PO4, K2HPO4 khi hoà tan trong nứơc phân li cho các anion HCO3-, H2PO4-, HPO4(2-). Các ion này là lưỡng tính. CHúng cũng phản ứng với nước làm biến đổi pH, môi trường của dung dịch tuỳ thuộc vào bản chất các anion.
-Muối Na2HPO3 vẫn còn hiđro nhưng là muối trung hoà.
* Một vài lưu ý thêm:
- Sự phân li của chất điện li yếu là một quá trình thuận nghịch dẫn đến cân bằng động (cân bằng điện li) Cân bằng điện li cũng có hằng số cân bằng K và tuân theo nguyên lí Lơ Sa – tơ – li – ê.
- Độ điện li chỉ phụ thuộc vào nhiệt độ khi điện li .
◙. CH3COOH---> CH3COO- + H+
k = [CH3COO-][H+]/[CH3COOH]
Khi hòa tan chất điện li CH3COONa vào dung dịch thì nồng độ CH3COO- tăng lên do sự phân li :
CH3COONa → Na+ + CH3COO-
Vì Ka không đổi → [H+] giảm xuống
◙. CH3COOH <--->CH3COO-+ H+
Độ điện li : α = [H+]/[CH3COOH]=[CH3COO-]/[CH3COOH]
a. Khi nhỏ HCl vào lượng H+ tăng lên cân bằng dịch chuyển sang phải lượng CH3COOH tăng lên → α giảm
b. Khi pha loãng dung dịch CH3COOH điện li nhiều → α tăng
c. Khi nhỏ vào dd NaOH cân bằng dịch chuyển sang phải, (vì H+ + OH-) → α tăng
d. CH3COO- tăng lên cân bằng dịch chuyển chiều nghịch (làm giảm nồng độ CH3COO- )
→ α giảm.
pH của các dung dịch.
1. pH của dung dịch axit mạnh và baz mạnh.
• Axit mạnh: pH=-log[H+]
• Baz mạnh: pH=14+log[OH-]
2. pH của dung dịch axit yếu và baz yếu.
• Axit yếu:pH=1/2(pKa-logCa)
• Baz yếu:pH=14-1/2(pKa-logCa)
V. Dung dịch đệm.
Định nghĩa: Dung dịch đệm là dd có giá trị pH xác định và hầu như không thay đổi khi pha loãng hoặc thêm vào một lượng nhỏ axit mạnh hay baz mạnh.
Phân loại dd đệm: tùy theo pH đệm ta có 3 loại hệ đệm:
• Hệ đệm axit: pH đệm < 7, dung dịch gồm một axit yếu và muối của nó.(TD: CH3COOH và CH3COONa).
• Hệ đệm baz: pH đệm > 7, dung dịch gồm một baz yếu và muối của nó. (TD: NH4OH và NH4Cl)
• Hệ đệm trung tính: pH đệm ≈ 7, dung dịch gồm hỗn hợp các muối axit của axit yếu đa bậc. (TD: NaH2PO4 và Na2HPO4)

O có số oxi hóa -2, H có số oxi hóa + 1
⇒ Số oxi hóa của các nguyên tố trong các phân tử và ion là:
CO2: x + 2.(-2) = 0 ⇒ x = 4 ⇒ C có số oxi hóa +4 trong CO2
H2O: H có số oxi hóa +1, O có số oxi hóa -2.
SO3: x + 3.(-2) = 0 ⇒ x = 6 ⇒ S có số oxi hóa +6 trong SO3
NH3: x + 3.1 = 0 ⇒ x = -3 ⇒ N có số oxi hóa -3 trong NH3
NO: x + 1.(-2) = 0 ⇒ x = 2 ⇒ N có số oxi hóa +2 trong NO
NO2: x + 2.(-2) = 0 ⇒ x = 4 ⇒ N có số oxi hóa +4 trong NO2
Cu2+ có số oxi hóa là +2.
Na+ có số oxi hóa là +1.
Fe2+ có số oxi hóa là +2.
Fe3+ có số oxi hóa là +3.
Al3+ có số oxi hóa là +3.
NH4+ có số õi hóa là -3

1. Trong dung dịch, điện tích của các cation bằng điện tích của các anion, nên :
2a + b = 2c + d
0,001.2 + 0,01 = 0,005.2 + d
⇒ d = 0,002
2. M g C l 2 và N a 2 S O 4 .

Đáp án A
Các ion cùng tồn tại trong 1 dung dịch là: (a), (i) vì các ion này không phản ứng tạo kết tủa.

Chọn B
1/ đúng.
2/ chưa đúng: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion có thể kết hợp với nhau tạo thành ít nhất một trong các chất sau: chất kết tủa, chất điện ly yếu, chất khí.
3/ đúng.
4/ chưa đúng: NaHCO 3 được dùng làm thuốc giảm đau dạ dày do thừa axit.
5/ đúng.