Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nguyên tử nguyên tố A có tổng số hạt electron trong các phân lớp p là 7.\(\Rightarrow\) Cấu hình e của A là: \(1s^22s^22p^63s^23p^1\)
Số electron của A là 13.
\(\Rightarrow\)Số hạt mang điện của A là 13*2=26(hạt)
Số hạt mang điện của B là 26+8=34(hạt)
\(\Rightarrow\)Số electron của B là 34:2=17(hạt)
Vậy A là Al và B là Cl.
Chọn B.

Theo đề ra ta có hệ phương trình:
\(\left\{{}\begin{matrix}2p+n=52\\2p-n=12\end{matrix}\right.\)
Giải ra ta được p = 16 => Z = 16
Cấu hình electron nguyên tử: 1s22s22p63s23p4
Từ đây ta biết được: Nguyên tố thuộc chu kì 3, nhóm IVA
Vậy nguyên tố cần tìm là Sulfur.

Đáp án C
Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp p là 7 → Cấu hình electron của X: 1s22s22p63s23p1
Số electron của X = 13 → số hạt mang điện của X = 2 x 13 = 26.
Số hạt mang điện của Y = 26 + 8 = 34 → Y có số hiệu nguyên tử Z = 34 : 2 = 17
→ X, Y lần lượt là Al và Cl → Chọn C.

\(\left\{{}\begin{matrix}2p+n=36\\2p-n=12\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}p=e=12\\n=12\end{matrix}\right.\)
\(A=Z+N=24\left(Cr\right)\)
Z=12

B
Gọi số proton, nơtron và electron của X là p, n và e (trong đó p = e)
Theo bài ra ta có hệ phương trình:
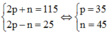
=> Cấu hình nguyên tử của X là
![]()



Bài 1
Gọi p, n, e lần lượt là số proton, nơtron và electron
a) Theo bài ra ta có:
{p+e+n=52p+e−n=16{p+e+n=52p+e−n=16⇔{2p+n=522p−n=16{2p+n=522p−n=16
⇔ p = e = 17 ; n = 18
b) _X là Clo
_Kí hiệu hóa học : ClCl
_Nguyên tử khối 35,5
c) Khối lượng tuyệt đối
mp + me + mn = 1,6726. 10-27. 17 + 9,1094. 10-31.17 + 1,6748. 10-27. 18 ≈ 5,8596. 10-26 kg ≈ 5,8593. 10-23 g.