Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. \(n_{KClO_3}=\dfrac{18.375}{122,5}=0,15\left(mol\right)\)
PTHH : 2KClO3 ----to---> 2KCl + 3O2
0,15 0,225
Phản ứng trên là phản ứng phân hủy . Vì phản ứng phân hủy là một phản ứng hóa học mà trong đó một chất tham gia có thể tạo thành hai hay nhiều chất mới.
b. \(V_{O_2}=0,225.22,4=5,04\left(l\right)\)
c. \(V_{kk}=5,04.5=25,2\left(l\right)\)

K M n O 4 K C l O 3 , H 2 O , H 2 O và ít tan trong nước, úp ngược miệng ống nghiệm vào trong nước.

\(n_{KMnO_4}=\dfrac{118,5}{158}=0,75\left(mol\right)\\
pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,75 0,375
=> \(V_{O_2}=0,375.22,4=8,4\left(l\right)\\
V_{kk}=8,4.5=42\left(l\right)\)

khi thu khí oxi vào ống nguyệm bằng cách đẩy không khí phải để vị trí ống nghiệm ngửa lên vì oxi nặng hơn kk nên có chiều hướng đi xuống
đối với hidro thì ko thể làm thế vì khí hidro nhẹ hơn kk nên chó chiều xuống bay lên nên muốn thu khí hidro bằng cách đẩy kk thì ta đặt ống thí nghiệm úp xuống

a. \(n_{KMnO_4}=\dfrac{118.5}{158}=0,75\left(mol\right)\)
PTHH : 2KMnO4 -----to----> K2MnO4 + MnO2 + O2
0,75 0,375
Phản ứng trên là phản ứng phân hủy . Vì phản ứng phân hủy là một phản ứng hóa học mà trong đó một chất tham gia có thể tạo thành hai hay nhiều chất mới.
b. \(V_{O_2}=0,375.22,4=8,4\left(l\right)\)
c. \(V_{kk}=8,4.5=42\left(l\right)\)
a) 2KMn04 --> K2MnO4 + MnO2 + O2↑
PƯ này thuộc loại PƯ phân hủy
b) Có nKMnO4 = \(\dfrac{118.5}{39+55+16.4}\)=\(\dfrac{3}{4}\)=0,75
=> nO2 = 0,75x \(\dfrac{1}{2}\)=0,375
=> V của O2 là: 0,375 x 22,4=8,4(l)
c) Thể tích của ko khí là: 1/5 x 8,4=1,68(l)

khi thu khí oxi vào ống nguyệm bằng cách đẩy không khí phải để vị trí ống nghiệm ngửa lên vì oxi nặng hơn kk nên có chiều hướng đi xuống
đối với hidro thì ko thể làm thế vì khí hidro nhẹ hơn kk nên chó chiều xuống bay lên nên muốn thu khí hidro bằng cách đẩy kk thì ta đặt ống thí nghiệm úp xuống
Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phảo để vị trí ống nghiệm nằm thẳng đứng, miệng ống nghiệm hướng lên trên vì trọng lượng khí oxi (32g) lớn hơn trọng lượng không khí (29g). Đối với khí hiđro thì không thể được vì trọng lượng khí hiđro rất nhẹ (2g) so với không khí (29g).

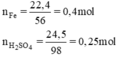
Phương trình hóa học của phản ứng:

So sánh tỉ lệ 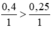 ⇒ Fe dư
⇒ Fe dư
Theo PT nFe (pư) = nH2SO4 = 0,25 mol ⇒ nFe dư = 0,4 – 0,25 = 0,15 mol
mFe dư = 0,15. 56 = 8,4g.
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4.
nH2 = nH2SO4 = 0,25 mol
Vkhí = 0,25 . 22,4 = 5,6l.

a) nFe=0,4(mol); nH2SO4=0,5(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
Ta có: 0,4/1 < 0,5/1
=> Fe hết, H2SO4 dư. tính theo nFe.
=> nH2= nH2SO4(p.ứ)=nFe=0,4(mol)
=>nH2SO4(dư)=0,5-0,4=0,1(mol)
=>H2SO4(dư)=0,1.98=9,8(g)
b) V(H2,dktc)=0,4.22,4=8,96(l)
Bài 1 : a , c
Bài 2 :
2Mg + O2 -to-> 2MgO => Hóa hợp
2KMnO4 -to-> K2MnO4 + MnO2 + O2 => Phân hủy
Fe + CuCl2 => FeCl2 + Cu => Thế
Bài 3 :
- Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phải để vị trí ống nghiệm nằm thẳng đứng, miệng ống nghiệm hướng lên trên vì trọng lượng khí oxi (32g) lớn hơn trọng lượng không khí (29g).
- Đối với khí hiđro thì không thể được vì trọng lượng khí hiđro rất nhẹ (2g) so với không khí (29g). Đối với khí H2 thì phải đặt ống nghiệm thẳng đứng và miệng ống nghiệm hướng xuống dưới.
Bài 5 :
nFe = 22.4/56 = 0.4 (mol)
nH2SO4 = 24.5/98 = 0.25 (mol)
Fe + H2SO4 => FeSO4 + H2
0.25__0.25____________0.25
mH2SO4 (dư) = ( 0.4 - 0.25) * 98 = 14.7(g)
VH2 = 0.25*22.4 = 5.6(l)
Bài 1: a,c
Bài 2:
a) \(2Mg+O_2\rightarrow2MgO\)
=> Phản ứng hóa hợp
b) \(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
=> Phản ứng phân hủy
c) \(Fe+CuCl_2\rightarrow FeCl_2+Cu\)
=> Phản ứng thế
Bài 3:
- Phải để vị trí ống nghiệm nằm thẳng đứng, miệng hướng lên trên ( Vì khó oxi nặng hơn không khí)
- Đối với khí hidro, không làm thế được vì khí hidro rất nhẹ so với không khí=> phải đặt ống nghiệm thẳng đứng và miệng ống hướng xuống dưới.
Bài 5:
a) Ta có:
\(n_{Fe}=\dfrac{m}{M}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{m}{M}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
Pt phản ứng: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2^{\uparrow}\)
Ta lập tỉ lệ: \(\dfrac{n_{Fe}}{h\text{ệ}s\text{ố}c\text{â}n=}=\dfrac{0,4}{1}=0,4\)
\(\dfrac{n_{H_2SO_4}}{h\text{ệ}s\text{ố}c\text{â}n=}=\dfrac{0,25}{1}=0,25\)
Ta thấy: 0,4>0,25 => Fe còn dư và H2SO4 phản ứng hết.
Theo pt phản ứng, ta có:
\(n_{Fe\left(p\text{ứ}\right)}=\dfrac{1}{1}n_{H_2SO_4}=\dfrac{1}{1}.0,25=0,25\left(mol\right)\)
\(\Rightarrow n_{Fe\left(d\text{ư}\right)}=n_{Fe\left(ban\text{đ}\text{ầu}\right)}-n_{Fe\left(p\text{ứ}\right)}=0,4-0,25=0,15\left(mol\right)\)
\(\Rightarrow m_{Fe\left(d\text{ư}\right)}=n.M=0,15.56=8,4\left(g\right)\)
Vậy Fe dư và dư 8,4g
b) The ptpu ta có:
\(n_{H_2}=\dfrac{1}{1}n_{H_2SO_4}=\dfrac{1}{1}.0,25=0,25\left(mol\right)\)
\(\Rightarrow V_{H_2\left(\text{đ}ktc\right)}=n.22,4=0,25.22,4=5,6\left(l\right)\)