Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) 2KClO3 -> 2KCl + 3O2
b) MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
b) SGK

1. Đốt nóng KMnO4 ở t độ cao:
\(2KMnO_4\rightarrow^{t^0}K_2MnO_4+MnO_2+O_2\uparrow\)
2. Cho Zn vào đ HCl thu được:
\(Zn+HCl\rightarrow ZnCl_2+H_2\uparrow\)
3. Thu O2: đẩy kk hoặc đẩy nước (Xem SGK)
Thu H2: đẩy nước hoặc đẩy kk (Xem SGK)
1 , nhiệt phân \(KMnO_4\)
\(2KMnO_4-t^o->K_2MnO_4+MnO_2+O_2\)

Câu 1 :
\(a) Na_2O + H_2O \to 2NaOH\\ b) NaOH + HCl \to NaCl + H_2O\\ \)
Câu 2 : Cho kim loại tác dụng với dung dịch HCl, H2SO4 loãng
\(Fe + 2HCl \to FeCl_2 + H_2\\ Mg + H_2SO_4 \to MgSO_4 + H_2\)
Câu 3 :
CuSO4 : Đồng II sunfat
ZnCl2 : Kẽm clorua
Fe2(SO4)3 : Sắt III sunfat
Pb(NO3)2 : Chì II nitrat
Câu 4 :
Trích mẫu thử
Cho các mẫu thử vào dung dịch nước vôi trong
- mẫu thử nào tạo vẩn đục trắng là CO2
\(CO_2 +C a(OH)_2 \to CaCO_3 + H_2O\)
- mẫu thử nào không hiện tượng gì là H2
Câu 5 :
\(2Cu + O_2 \xrightarrow{t^o} 2CuO\\ CuO + H_2SO_4 \to CuSO_4 + H_2O\\ CuSO_4 + 2KOH \to Cu(OH)_2 + K_2SO_4\)

a)
Nung các hợp chất giàu O2 như KMnO4 , KClO3 , ....
b)
\(2KMnO_4\underrightarrow{^{t^0}}K_2MnO_4+MnO_2+O_2\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
a, - Thường được điều chế bằng cách nung nóng KMnO4 .
b, PTHH : 2KMnO4 -> K2MnO4 + MnO2 + O2

2Al + 6HCl --> 2AlCl3 + 3H2
Fe + 2HCl --> FeCl2 + H2
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
Fe + H2SO4 --> FeSO4 + H2

a) 2KClO3 (7/75 mol) \(\underrightarrow{t^o}\) 2KCl (7/75 mol) + 3O2\(\uparrow\) (0,14 mol).
b) Số mol khí oxi là 4,48/32=0,14 (mol).
Khối lượng kali clorat cần dùng là 7/75.122,5=343/30 (g).
Khối lượng chất rắn thu được là 7/75.74,5=1043/150 (g).
\(a,PTHH:2KClO_3\underrightarrow{t^o,MnO_2}2KCl+3O_2\uparrow\\ b,n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ Theo.pt:n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ m_{KClO_3}=\dfrac{2}{15}.122,5=\dfrac{49}{3}\left(g\right)\)
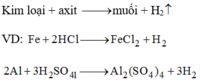
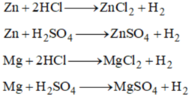
a. – Trong phòng thí nghiệm để điều chế H2 thường sử dụng axit HCl (hoặc H2SO4 loãng) và kim loại Zn (hoặc Fe, hoặc Al).
Zn + 2HCl → ZnCl2 + H2↑
– Khí H2 ít tan trong nước và nhẹ hơn không khí nên ta có thể thu H2 theo 2 cách: Đẩy nước và đẩy không khí.
b. – Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao.
2KMnO4 ---t° → K2MnO4 + MnO2 + O2
2KClO3 ---t° → 2KCl + 3O2
– Khí O2 ít tan trong nước và nặng hơn không khí nên ta có thể thu O2 theo 2 cách: Đẩy nước và đẩy không khí.