Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Ta có: \(n_{CH_4}+n_{C_2H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(1\right)\)
\(16n_{CH_4}+28n_{C_2H_4}=3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,1\left(mol\right)\\n_{C_2H_4}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%\approx53,33\%\\\%m_{C_2H_4}\approx46,67\%\end{matrix}\right.\)
- Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là %V.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%\approx66,67\%\\\%V_{C_2H_4}\approx33,33\%\end{matrix}\right.\)
b, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Có: m tăng = mC2H4 = 0,05.28 = 1,4 (g)
a) \(n_{hh}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=0,15\\16a+28b=3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%=66,67\%\\\%V_{C_2H_4}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%=53,33\%\\\%m_{C_2H_4}=100\%-53,33\%=46,67\%\end{matrix}\right.\)
b) \(m=m_{C_2H_4}=0,05.28=1,4\left(g\right)\)

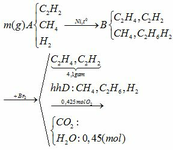
C2H2 + H2 C2H4
C2H2 + H2 C2H6
Khi cho hỗn hợp B qua dd nước Br2 chỉ có C2H4 và C2H2 phản ứng C2H2 +2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2
=> khối lượng bình Br2 tăng chính bằng khối lượng của C2H2 và C2H4
mC2H2 + mC2H4 = 4,1 (g)
Hỗn hợp khí D đi ra là CH4, C2H6 và H2
CH4 + 2O2 → t ∘ CO2 + 2H2O
C2H6 + O2 → t ∘ 2CO2 + 3H2O
2H2 + O2 → t ∘ 2H2O
Bảo toàn nguyên tố O cho quá trình đốt cháy hh D ta có:
2nCO2 = 2nO2 – nH2O => nCO2 = ( 0,425. 2– 0,45)/2 = 0,2 (mol)
Bảo toàn khối lượng : mhh D = mCO2 + mH2O – mO2 = 0,2.44 + 0,45.18 – 0,425.32 = 3,3 (g)
Bảo toàn khối lương: mA = (mC2H2 + mC2H4) + mhh D = 4,1 + 3,3 = 7,4 (g)

a, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
Giả sử: \(\left\{{}\begin{matrix}n_{C_2H_4}=x\left(mol\right)\\n_{C_2H_2}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow x+y=\dfrac{1,344}{22,4}=0,06\left(1\right)\)
Ta có: \(n_{Br_2}=\dfrac{16}{160}=0,1\left(mol\right)\)
Theo PT: \(n_{Br_2}=n_{C_2H_4}+2n_{C_2H_2}=x+2y\left(mol\right)\)
⇒ x + 2y = 0,1 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,02\left(mol\right)\\y=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,02}{0,06}.100\%\approx33,33\%\\\%\text{ }V_{C_2H_2}\approx66,67\%\end{matrix}\right.\)
b, Ta có: 1/2 hỗn hợp khí gồm: 0,01 mol C2H4 và 0,02 mol C2H2.
PT: \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Theo PT: \(n_{CO_2}=2n_{C_2H_4}+2n_{C_2H_2}=0,06\left(mol\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
Theo PT: \(n_{CaCO_3}=n_{CO_2}=0,06\left(mol\right)\)
\(\Rightarrow m_{cr}=m_{CaCO_3}=0,06.100=6\left(g\right)\)
Bạn tham khảo nhé!

nBr2 = 0,125 mol
Khi đốt cháy nA = 0,25 mol
mNaOH ban đầu = 36g => nNaOH = 0,9 mol
Gọi x, y lần lượt là số mol của CO2 và H2O
mdd = 180 + 44x + 18y
Vì NaOH dư do đó chỉ tạo muối trung hòa
CO2 +2NaOH → Na2CO3 + H2O
x 2x
nNaOH dư = 0,9 – 2x
có 2 , 75 % = 40 ( 0 , 9 - 2 x ) 180 + 44 x + 18 y . 100 % (1)
=> 81,21x + 0,495y = 31,05n
2,8 lít khí A tác dụng với 0,125 mol Br2
=> 5,6 lít khí A tác dụng với 0,25 mol Br2
Gọi số mol khí của CH4, C2H4 và C2H2 lần lượt là a; b; c
Ta có a + b + c = 0,25 mol
Và b + 2c = 0,25
=> a = c
=> khi đốt cháy hỗn hợp A cho nCO2 = nH2O
Thay vào (1) => x = y = 0,38 mol
Bảo toàn C, H khi đốt cháy ta có
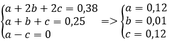
=> %VCH4 = %VC2H2 = 48%
%VC2H4 = 4%

Tính % thể tích các khí :
% V C 2 H 2 = 0,448/0,896 x 100% = 50%
% V CH 4 = % V C 2 H 6 = 25%

ta có :
nBr2=\(\dfrac{16}{160}=0,1mol\)
C2H4+Br2->C2H4Br2
0,1------0,1
=>VC2H4=0,1.22,4=2,24l
=>VCH4=3,36l->n CH4=0,15 mol
->%VC2H4=\(\dfrac{2,24}{5,6}.100\)=40%
=>%VCH4=60%
c)
CH4+2O2-to>CO2+2H2O
0,15---------------0,15
C2H4+3O2--to>2CO2+2H2O
0,1--------------------0,2
=>m CaCO3=0,35.100=35g
a, \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
\(n_{Br_2}=\dfrac{16}{160}=0,1\left(mol\right)\)
Theo PT: \(n_{C_2H_2}=\dfrac{1}{2}n_{Br_2}=0,05\left(mol\right)\)
\(\Rightarrow V_{C_2H_2}=0,05.22,4=1,12\left(l\right)\)
\(\Rightarrow V_{CH_4}=3,36-1,12=2,24\left(l\right)\)
b, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
\(n_{CH_4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=0,325\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,325.22,4=7,28\left(l\right)\Rightarrow V_{kk}=5V_{O_2}=36,4\left(l\right)\)
Theo PT: \(n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=0,2\left(mol\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
\(\Rightarrow n_{CaCO_3}=n_{CO_2}=0,2\left(mol\right)\Rightarrow m_{CaCO_3}=0,2.100=20\left(g\right)\)