Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 23 bạn tự áp vào công thức là tính ra Ea thôi. Nên em tự làm nhé
Câu 24: \(\overline{v}=\frac{\left|\Delta C\right|}{\Delta t}=\frac{0,05}{1}=0,05M.phút^{-1}\)
Câu 25
vsau = vtrước.3,33(80-25):10= 747.vtrước
=> Thời gian thực hiện pứ = 2/747 giờ

Đáp án C
Tốc độ phản ứng tức thời: v = k[H2]3.[N2]
Vậy khi tăng nồng độ H2 lên hai lần (giữ nguyên nồng độ của khí nitơ và nhiệt độ của phản ứng) thì tốc độ phản ứng tăng lên 23 = 8 lần.

Đáp án C
Tốc độ phản ứng tức thời: v = k[H2]3.[N2]
Vậy khi tăng nồng độ H2 lên hai lần (giữ nguyên nồng độ của khí nitơ và nhiệt độ của phản ứng) thì tốc độ phản ứng tăng lên 23 = 8 lần.

Đáp án B
Theo định nghĩa, số lần tăng tốc độ phản ứng khi nhiệt độ thay đổi 100C chính là hệ số nhiệt độ γ.
Suy ra γ = 3.
Gọi nhiệt độ sau khi tăng là t2
Thay vào công thức ta có
81 = 3 ( 1 - 30 ) / 10 ⇔ ( t 2 - 30 ) 10 = 4 ⇔ t 2 = 70 0 C

Đáp án B
Theo định nghĩa, số lần tăng tốc độ phản ứng khi nhiệt độ thay đổi 100C chính là hệ số nhiệt độ γ.
Suy ra γ = 3.
Gọi nhiệt độ sau khi tăng là t2
Thay vào công thức ta có
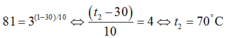
Câu 21, 23: Em thay dữ kiện vào công thức:
\(ln\frac{k_1}{k_2}=\frac{-E_a}{R}.\left(\frac{1}{T_1}-\frac{1}{T_2}\right)\)
Câu 22: không đổi do tốc độ pứ hệ không phụ thuộc vào thể tích hỗn hợp.