Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

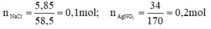
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
Theo pt: nAgNO3 pư = nAgCl = nNaCl = 0,1 mol
b) Vdd = 300 + 200 = 500 ml
nAgNO3 dư = 0,2 – 0, 1 = 0,1 mol; nNaNO3 = nNaCl = 0,1 mol
CM(NaNO3) = CM(AgNO3) = 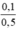 = 0,2 mol/l.
= 0,2 mol/l.

Chất rắn k tan là Cu và có KL là 1g
\(Fe2O3+6HCl-->2FeCl3+3H2O\)
\(FeCl3+3NaOH-->Fe\left(OH\right)3+3NaCl\)
\(2Fe\left(OH\right)3-->Fe2O3+3H2O\)
\(n_{Fe2O3}=\frac{32}{160}=0,2\left(mol\right)\)
\(n_{Fe\left(OH\right)3}=2n_{Fe2O3}=0,4\left(mol\right)\)
\(n_{FeCl3}=n_{Fe\left(OH\right)3}=0,4\left(mol\right)\)
\(n_{Fe2O3}=\frac{1}{2}n_{FeCl3}=0,2\left(mol\right)\)
\(m_{Fe2O3}=0,2.160=32\left(g\right)\)
\(m=mFe2O3+m_{Cu}=32+1=33\left(g\right)\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(2FeCl_3+Cu\rightarrow CuCl_2+2FeCl_3\)
\(CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaCl\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
\(4Fe\left(OH\right)_2+2H_2O+O_2\rightarrow4Fe\left(OH\right)_2\)
\(Cu\left(OH\right)_2+CuO+H_2O\)
\(2Fe\left(OH\right)_3\rightarrow Fe_2O_3+3H_2O\)
\(a:Fe_2O_3\)
\(\Rightarrow n_{Cu_{pư}}=0,5a\left(mol\right)\)
\(160a+0,5a.80=32\)
\(\Rightarrow a=0,16\left(mol\right)\)
\(m_{Fe2O3}=0,16.160=25,6\)
\(m_{Cu}=0,08.64+1=6,12\left(g\right)\)
\(\Rightarrow m=25,6+6,12=31,72\left(g\right)\)

a.
Do E gồm hai oxit nên Mg, CuCl2 hết, Fe đã phản ứng
Phương trình
Mg + CuCl2 \(\rightarrow\) MgCl2 + Cu (1)
Fe + CuCl2 \(\rightarrow\) FeCl2 + Cu (2)
Khi cho NaOH dư vào
2NaOH + MgCl2 \(\rightarrow\) Mg(OH)2 + 2NaCl (3)
2NaOH + FeCl2 \(\rightarrow\) Fe(OH)2 + 2NaCl (4)
Khi nung
Mg(OH)2 \(\underrightarrow{t^o}\) MgO + H2O (5)
4Fe(OH)2 +O2 \(\underrightarrow{t^o}\) 4Fe2O3 + 4H2O (6)
b.
Đặt số mol của Fe, Mg có ban đầu lần lượt là x, y, số mol Fe dư là t (x, y>0, t\(\ge\)0)
Có hệ \(\begin{cases}24x+56y+0t=3,16\\40x+64y-8t=3,84\\40x+80y-80t=1,4\end{cases}\)\(\Rightarrow\)\(\begin{cases}x=0,015mol\\y=0,05mol\\t=0,04mol\end{cases}\)
Vậy trong hỗn hợp đầu %mMg = \(\frac{0,015.24}{3,16}.100\)=11,392%
%mFe=100%-11,392% = 88,608%
Nồng độ của CuCl2: z =0,025:0,25=0,1M

nNaCl = = 0,1 mol;
=
= 0,2 mol
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
0,1 mol 0,1 mol 0,1 mol 0,1 mol
mAgCl = 143,5 x 0,1 = 14,35g
b) Vdd = 300 + 200 = 500 ml
= 0,2 - 0,1 = 0,1 mol
=
=
= 0,2 mol/l
\(n_{NaCl}=\frac{5,85}{58,5}=0,1\left(mol\right)\)
\(n_{AgNO_3}=\frac{34}{170}=0,2\left(mol\right)\)
\(NaCl+AgNO_3->AgCl+NaNO_3\) (1)
vì \(\frac{0,1}{1}< \frac{0,2}{1}\) => \(AgNO_3dư\)
theo (1) \(n_{AgCl}=n_{NaCl}=0,1\left(mol\right)\)
=> \(m_{AgCl}=143,5.0,1=14,35\left(g\right)\)
b, 300ml=0,3l , 200ml = 0,2 l
\(V_{dd}=0,3+0,2=0,5\left(l\right)\)
theo (1) \(n_{AgNO_3\left(pư\right)}=n_{NaCl}=0,1\left(mol\right)\)
=> \(n_{AgNO_3\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
\(C_{M\left(NaNO_3\right)}=\frac{0,1}{0,5}=0,2M\)

Gọi nồng độ mol của \(Fe_2\left(SO_4\right)_3\) và \(Ba\left(OH\right)_2\) lần lượt là x;y(mol)
\(Fe_2\left(SO_4\right)_3+3Ba\left(OH\right)_2-->2Fe\left(OH\right)_3+3BaSO_4\\ H_2SO_4+Ba\left(OH\right)_2-->BaSO_4+2H_2O\\ 2Fe\left(OH\right)_3-t^o->Fe_2O_3+3H_2O\)
Ta có: \(0,1x.160+\left(0,1y-0,004\right).233=4,925\)
Mặt khác \(0,3x=\left(0,1y-0,004\right)\)
Giải hệ ta được x;y

a) \(n_{NACl}=\frac{5,85}{58,5}=0,1\left(mol\right)\)
\(n_{AgNO_3}=\frac{34}{170}=0,2\left(mol\right)\)
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
0,1 \(\rightarrow\) 0,1 \(\rightarrow\) 0,1 \(\rightarrow\) 0,1 (mol)
\(m_{AgCl}=143,5.0,1=14,35g\)
b) \(V_{dd}=300+200=500\left(ml\right)\)
\(C_M\left(NaNO_3\right)=C_M\left(AgNO_3\right)=\frac{0,1}{0,5}=0,2\left(M\right)\)
a)nNaCl=0,1 mol , nAgNO3=0,2 mol
NaCl+AgNO3---->AgCl+NaNO3
theo pt và theo bài ra: NaCl hết, AgNO3 dư 0,1 mol
=> nAgCl=nNaCl=0,1=>mAgCl=14,35 gam.
b) thể tích sau phản ứng=200+300=500 ml= 0,5 lít
Nồng độ CMAgNO3=CMNaNO3=0,1/0,5=0,2.
a/
\(CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+2NaCl\)
\(Cu\left(ỌH\right)_2\rightarrow CuO+H_2O\)
b/
\(n_{NaOH}=\dfrac{10}{40}=0,25\left(mol\right)\)
\(n_{Cu\left(ỌH\right)_2}=\dfrac{1}{2}n_{NaOH}=0,125\left(mol\right)\)
\(\rightarrow m_{Cu\left(OH\right)_2}=0,125.98=12,25\left(g\right)\)
\(n_{CuO}=n_{Cu\left(OH\right)_2}=0,125\left(mol\right)\)
\(\rightarrow m_{CuO}=0,125.80=10\left(g\right)\)
c/
\(V_{dd}=100+200=300\left(ml\right)=0,3\left(l\right)\)
\(n_{NaCl}=n_{NaOH}=0,25\left(mol\right)\)
\(\Rightarrow C_{M_{NaCl}}=\dfrac{0,25}{0,3}\approx0,83M\)