Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a/ Gọi x và y là số mol của Cu và Mg ban đầu.
Ta có: 64x + 24y = 7.6 g
<=> 8x + 3y = 0.95 (1)
2Cu + O2 ---------------> 2CuO
x ------------------------------ x mol
2Mg + O2 ---------------> 2MgO
y ------------------------------ y mol
Từ 2 ptpứ ta có KL hỗn hợp sau pứ là: m = 80x + 40y
Vì KL MgO chiếm 20% KL hỗn hợp nên:
\(\dfrac{40y}{80x+40y}\) = 20% = 0.2
<=> 40y = 0.2(80x + 40y)
<=> 40y = 16x + 8y
<=> 32y = 16x
<=> x = 2y. Thế vào (1) ta có:
<=>8.2y + 3y = 0.95
<=> 19y =0.95
<=> y = 0.05 mol.
===> x = 2.0.05 = 0.1 mol.
Vậy khối lượng Mg: m = 0.05.24 = 1.2 g
mCu: m = 7.6 - 1.2 = 6.4 g.
b/
2HCl `+ `CuO -------> CuCl2 + H2O
0.2 <--- 0.1 mol
2HCl ` + `MgO ------> MgCl2 + H2O
0.2 <----- 0.1 mol
Từ 2 pt trên ta tính lượng axit HCl nguyên chất cần dùng: n = 0.2 + 0.2 = 0.4 mol.
=>VHCl=\(\dfrac{0,4}{0,5}\)=0,8l=800ml

a) Gọi số mol Cu, Mg là a, b (mol)
=> 64a + 24b = 7,6 (1)
PTHH: 2Cu + O2 --to--> 2CuO
a---------------->a
2Mg + O2 --to--> 2MgO
b------------------>b
=> \(\%MgO=\dfrac{40b}{80a+40b}.100\%=20\%\)
=> a = 2b (2)
(1)(2) => a = 0,1; b = 0,05
=> \(\left\{{}\begin{matrix}m_{Cu}=0,1.64=6,4\left(g\right)\\m_{Mg}=0,05.24=1,2\left(g\right)\end{matrix}\right.\)
b)
PTHH: CuO + H2SO4 --> CuSO4 + H2O
0,1--->0,1
MgO + H2SO4 --> MgSO4 + H2O
0,05--->0,05
=> \(V_{ddH_2SO_4}=\dfrac{0,1+0,05}{0,5}=0,3\left(l\right)\)
Ủa anh ra khác em luôn...để anh xem lại

Gọi số mol Al, Mg là a, b (mol)
=> 27a + 24b = 12,6 (1)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
a-->0,75a
2Mg + O2 --to--> 2MgO
b-->0,5b
=> 0,75a + 0,5b = 0,3 (2)
(1)(2) => a = 0,2 (mol); b = 0,3 (mol)
\(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{12,6}.100\%=42,86\%\\\%m_{Mg}=\dfrac{0,3.24}{12,6}.100\%=57,14\%\end{matrix}\right.\)
4Al (x mol) + 3O2 (0,75x mol) \(\underrightarrow{t^o}\) 2Al2O3.
2Mg (y mol) + O2 (0,5y mol) \(\underrightarrow{t^o}\) 2MgO.
Gọi x (mol) và y (mol) lần lượt là số mol của Al và Mg.
Số mol khí oxi cần dùng là 6,72:22,4=0,3 (mol)
Ta có: 27x+24y=12,6 (1).
Lại có: 0,75x+0,5y=0,3 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra x=0,2 (mol) và y=0,3 (mol).
%mAl=0,2.27/12,6\(\approx\)42,86%, %mMg=0,3.24/12,6\(\approx\)57,14%.

Đáp án B.
Bảo toàn khối lượng:
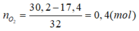
=> V = 0,4.22,4 = 8,96 (lít)

Câu 1:
Đặt \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}n_{CuO}=n_{Cu}=b\left(mol\right)\\n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=\dfrac{1}{2}a\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow102\cdot\dfrac{1}{2}a+80b=21,1\) (1)
Ta có: \(n_{O_2}=\dfrac{3,92}{22,4}=0,175\left(mol\right)\)
Bảo toàn electron: \(3a+2b=0,7\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,1\cdot27=2,7\left(g\right)\\m_{Cu}=0,2\cdot64=12,8\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{2,7}{2,7+12,8}\cdot100\%\approx17,42\%\\\%m_{Cu}=82,58\%\end{matrix}\right.\)
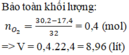
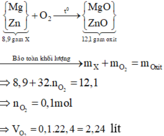
Bài 1
a)\(2Zn+O2-->2ZnO\)
b)\(n_{ZnO}=\frac{48,6}{81}=0,6\left(mol\right)\)
\(n_{O2}=\frac{1}{2}n_{Zn}=0,3\left(mol\right)\)
\(V_{O2}=0,3.22,4=6,72\left(l\right)\)
c)Cách 1
\(n_{Zn}=n_{ZnO}=0,6\left(mol\right)\)
\(m_{Zn}=0,6.65=39\left(g\right)\)
Cách 2
\(m_{O2}=0,3.32=9,6\left(g\right)\)
\(m_{Zn}=m_{ZnO}-m_{O2}=48,6-9,6=39\left(g\right)\)
Bài 2
a)\(m_{Mg}=9,6.12,5\%=1,2\left(g\right)\)
\(m_{Fe}=9,6-1,2=8,4\left(g\right)\)
b)\(2Mg+O2-->2MgO\)
\(3Fe+2O2-->Fe3O4\)
\(n_{Mg}=\frac{1,2}{24}=0,05\left(mol\right)\)
\(n_{Fe}=\frac{8,4}{56}=0,15\left(mol\right)\)
\(n_{MgO}=n_{Mg}=0,05\left(mol\right)\)
\(m_{gO}=0,05.40=2\left(g\right)\)
\(n_{Fe3O4}=\frac{1}{3}n_{Fe}=0,05\left(mol\right)\)
\(m_{Fe3O4}=0,05.232=11,6\left(g\right)\)