

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Câu 3 :
\(n_{HCl}=\dfrac{10\cdot21.9\%}{36.5}=0.06\left(mol\right)\)
\(AO+2HCl\rightarrow ACl_2+H_2O\)
\(0.03........0.06\)
\(M=\dfrac{2.4}{0.03}=80\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow A=64\)
\(CuO\)
Câu 2 :
$n_{CuO} = \dfrac{1,6}{80} = 0,02(mol)$
$n_{H_2SO_4} = \dfrac{100.20\%}{98} = \dfrac{10}{49}$
$CuO + H_2SO_4 \to CuSO_4 + H_2O$
$n_{CuO} < n_{H_2SO_4}$ nên $H_2SO_4 dư
Theo PTHH :
$n_{CuSO_4} = n_{H_2SO_4\ pư} = n_{CuO} = 0,02(mol)$
$m_{dd} = 1,6 + 100 = 101,6(gam)$
Vậy :
$C\%_{CuSO_4} = \dfrac{0,02.160}{101,6}.100\% = 3,15\%$
$C\%_{H_2SO_4\ dư} = \dfrac{100.20\% - 0,02.98}{101,6}.100\% = 17,6\%$

nCuO=2,4/80=0,03(mol)
m(H2SO4)=29,4%.100=29,4(g) -> nH2SO4=29,4/98=0,3(mol)
a) PTHH: CuO + H2SO4 -> CuSO4 + H2O
Ta có: 0,03/1 < 0,3/1
b)=> CuO hết, H2SO4 dư => Tính theo nCuO
nH2SO4(p.ứ)=nCuSO4=nCuO=0,03(mol)
=>nH2SO4(dư)=0,3-0,03=0,27(mol)
=>mH2SO4(dư)=0,27. 98= 26,46(g)
b) mCuSO4=0,03.160= 4,8(g)
mddsau= 2,4+ 100=102,4(g)
C%ddCuSO4= (4,8/102,4).100=4,6875%
C%ddH2SO4(dư)= (26,46/102,4).100= 25,84%
Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{2,4}{80}=0,03\left(mol\right)\)
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{29,4.100}{100}=29,4\left(g\right)\)
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
a) Pt : CuO + H2SO4 → CuSO4 + H2O\(|\)
1 1 1 1
0,03 0,3 0,03
b) Lập tỉ số so sánh : \(\dfrac{0,03}{1}< \dfrac{0,3}{1}\)
⇒ CuO phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của CuO
Số mol dư của axit sunfuric
ndư = nban đầu - nmol
= 0,3 - (0,03 . 1)
= 0,27 (mol)
Khối lượng dư của axit sunfuric
mdư = ndư . MH2SO4
= 0,27 . 98
= 26,46 (g)
c) Số mol của đồng (II) sunfat
nCuSO4 = \(\dfrac{0,03.1}{1}=0,03\left(mol\right)\)
Khối lượng của đồng (II) sunfat
mCuSO4 = nCuSO4 . MCuSO4
= 0,03 . 160
= 4,8 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mCuO + mH2SO4
= 2,4 + 100
= 102,4 (g)
Nồng độ phần trăm của đồng (II) sunfat
C0/0CuSO4= \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{4,8.100}{102,4}=4,6875\)0/0
Nồng độ phần trăm của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{26,46.100}{102,4}=25,84\)0/0
Chúc bạn học tốt

$n_{CuO} = \dfrac{8}{80} = 0,1(mol) ; n_{HCl} = 0,15.2 = 0,3(mol)$
$CuO + 2HCl \to CuCl_2 + H_2O$
Ta thấy :
$n_{CuO} : 1 < n_{HCl} : 2$ nên HCl dư
$n_{CuCl_2} = n_{CuO} = 0,1(mol)$
$n_{HCl\ pư} = 2n_{CuO} = 0,2(mol) \Rightarrow n_{HCl\ dư} = 0,3 - 0,2 = 0,1(mol)$
$C_{M_{CuCl_2}} = \dfrac{0,1}{0,15} = 0,67M$
$C_{M_{HCl}} = \dfrac{0,1}{0,15} = 0,67M$

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
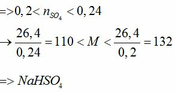
b)
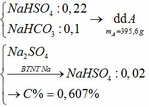
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

\(n_{CuO}=\dfrac{8}{80}=0.1\left(mol\right)\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(0.1...........0.1.........0.1\)
\(n_{NaOH}=0.24\cdot0.5=0.12\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
\(0.12..........0.06\)
\(n_{H_2SO_4}=0.1+0.06=0.16\left(mol\right)\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.16}{1}=0.16\left(l\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.06}{0.16}=0.375\left(M\right)\)
\(C_{M_{CuSO_4}}=\dfrac{0.1}{0.16}=0.625\left(M\right)\)