Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, CuO + H2SO4 ---> CuSO4 + H2
a mol a mol
FeO + H2SO4 ---> FeSO4 + H2
b mol b mol
Gọi số mol của CuO là a (mol), Feo là b (mol)
Ta có nH2SO4=0,210,21=0,2 mol
Ta có hệ pt:
{80a + 72b = 15 g
{a + b = 0,2 mol
=> a=0,075 mol , b=0,125 mol
=> %CuO=0,075.8015.100=40%0,075.8015.100=40%
%FeO=100-40=60%
b, FeO + 2HCl ---> FeCl2 +H2O
0,125 mol 0,25 mol
CuO + 2HCl ---> CuCl2 +H2O
0,075 mol 0,15 mol
=> mct HCl=(0,25+0,15).36,5=14,6 g
=> mdd HCl=14,6:0,3≈48,7 g

Pt : CuO + 2HCl → CuCl2 + H2O\(|\)
1 2 1 1
a 2a
ZnO + 2HCl → ZnCl2 + H2O\(|\)
1 2 1 1
b 2b
a) Gọi a là số mol của CuO
b là số mol của ZnO
Theo đề ta có : mCuO + mZnO = 12,1 (g)
⇒ nCuO . MCuO + nZnO . MZnO = 12,1 g
80a + 81b = 12,1g (1)
100ml= 0,1l
Số mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}\Rightarrow n=C_M.V=3.0,1=0,3\left(mol\right)\)
⇒ 2a + 2b = 0,3 (2)
Từ (1),(2) ta có hệ phương trình :
80a + 81b = 12,1
2a + 2b = 0,3
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,1\end{matrix}\right.\)
Khối lượng của đồng (II) oxit
mCuO = nCuO . MCuO
= 0,05 . 80
= 4 (g)
Khối lượng của kẽm oxit
mZnO = nZnO . MZnO
= 0,1. 81
= 8,1 (g)
0/0CuO = \(\dfrac{m_{CnO}.100}{m_{hh}}=\dfrac{4.100}{12,1}=33,06\)0/0
0/0ZnO = \(\dfrac{m_{ZnO}.100}{m_{hh}}=\dfrac{8,1.100}{12,1}=66,94\)0/0
b) Pt : CuO + H2SO4 → CuSO4 + H2O\(|\)
1 1 1 1
0,05 0,05
ZnO + H2SO4 → ZnSO4 + H2O\(|\)
1 1 1 1
0,1 0,1
Số mol tổng của axit sunfuric
nH2SO4 = 0,05 + 0,1
= 0,15 (mol)
Khối lượng của axit sunfuric
mH2SO4 = nH2SO4 . MH2SO4
= 0,15 . 98
= 14,7 (g)
Khối lượng của dung dịch axit sunfuirc cần dùng
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{14,7.100}{20}=73,5\left(g\right)\)
Chúc bạn học tốt
Gọi x,y lần lượt là số mol của CuO và ZnO
Số mol HCl
N=Cm×V= 3×0,1=0,3mol
Lập PTHH
CuO + 2HCl --> CuCl2 + H2O
x-->2x
ZnO + 2HCl --> ZnCl2 + H2O
y--> 2y
Theo PTPƯ ta có
2x+2y=0.3 (1)
Theo đề bài ta có
mCuO+mZnO =80x + 81y= 12,1g (2)
Từ (1),(2) =>
80x+81y=12,1g=>x=0.05 mol
2x+2y=0,3=>y=0,1mol
a) %CuO=0,05×80×100/12,1=33,06%
%ZnO=0,1×80×100/12,1=66,94%
b)CuO+H2SO4-->CuSO4 +H2O
0,05---> 0,05
ZnO+H2SO4-->ZnSO4+H2O
0,1--->0,1
nH2SO4=0,05+0,1=0,15mol
mH2SO4=0,15×98=14,7g
mddH2SO4 =14,7:20=73,5g
Có j sai đừng trách nha

Đổi 300ml = 0,3 lít
Ta có: \(n_{HCl}=2.0,3=0,6\left(mol\right)\)
a. PTHH:
CuO + 2HCl ---> CuCl2 + H2O (1)
ZnO + 2HCl ---> ZnCl2 + H2O (2)
b. Gọi x, y lần lượt là số mol của CuO và ZnO
Theo PT(1): \(n_{HCl}=2.n_{CuO}=2x\left(mol\right)\)
Theo PT(2): \(n_{HCl}=2.n_{ZnO}=2y\left(mol\right)\)
=> 2x + 2y = 0,6 (*)
Theo đề, ta có: 80x + 81y = 24,2 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}2x+2y=0,6\\80x+81y=24,2\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=> \(m_{CuO}=0,1.80=8\left(g\right)\)
=> \(\%_{m_{CuO}}=\dfrac{8}{24,2}.100\%=33,06\%\)
\(\%_{m_{Zn}}=100\%-33,06\%=66,94\%\)
c. PTHH:
CuO + H2SO4 ---> CuSO4 + H2O (3)
ZnO + H2SO4 ---> ZnSO4 + H2O (4)
Theo PT(3): \(n_{H_2SO_4}=n_{CuO}=0,1\left(mol\right)\)
Theo PT(4): \(n_{H_2SO_4}=n_{ZnO}=0,2\left(mol\right)\)
=> \(n_{H_2SO_4}=0,1+0,2=0,3\left(mol\right)\)
=> \(m_{H_2SO_4}=0,3.98=29,4\left(g\right)\)
Ta có: \(C_{\%_{H_2SO_4}}=\dfrac{29,4}{m_{dd_{H_2SO_4}}}.100\%=20\%\)
=> \(m_{dd_{H_2SO_4}}=147\left(g\right)\)

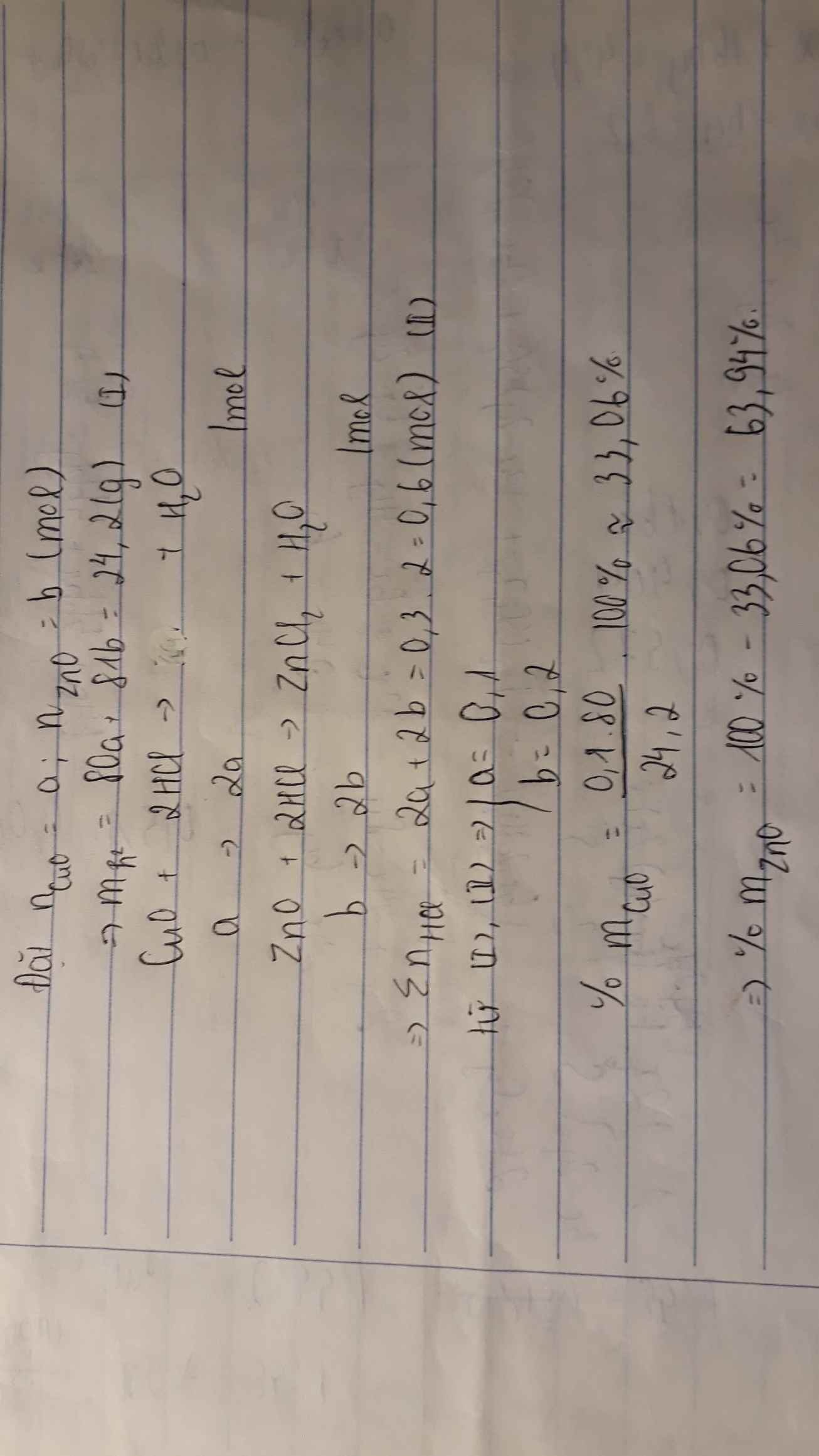
Bài 1 :
Pt : \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
a 1a
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O|\)
1 1 1 1
b 1b
a) Gọi a là số mol của CuO
b là số mol của FeO
\(m_{CuO}+m_{FeO}=15\left(g\right)\)
⇒ \(n_{CuO}.M_{CuO}+n_{FeO}.M_{FeO}=15g\)
⇒ 80a + 72b= 15g(1)
Ta có : 200ml = 0,2;l
\(n_{H2SO4}=1.0,2=0,2\left(mol\right)\)
⇒ 2a + 2b = 0,2(2)
Từ (1),(2), ta có hệ phương trình :
80a + 72b = 15
2a + 2b = 0,2
⇒ \(\left\{{}\begin{matrix}a=0,075\\b=0,125\end{matrix}\right.\)
\(m_{CuO}=0,075.80=6\left(g\right)\)
\(m_{FeO}=0,125.72=9\left(g\right)\)
0/0CuO = \(\dfrac{6.100}{15}=40\)0/0
0/0FeO = \(\dfrac{9.100}{15}=60\)0/0
b) Pt : \(CuO+2HCl\rightarrow CuCl_2+H_2O|\)
1 2 1 1
0,075 0,15
\(FeO+2HCl\rightarrow FeCl_2+H_2O|\)
1 2 1 1
0,125 0,25
\(n_{HCl\left(tổng\right)}=0,15+0,25=0,4\left(mol\right)\)
⇒ \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(m_{ddHCl}=\dfrac{14,6.100}{30}=48,67\left(g\right)\)
Chúc bạn học tốt
a, CuO + H2SO4 ---> CuSO4 + H2
a mol a mol
FeO + H2SO4 ---> FeSO4 + H2
b mol b mol
Gọi số mol của CuO là a (mol), Feo là b (mol)
Ta có nH2SO4=\(\dfrac{0,2}{1}\)=0,2 mol
Ta có hệ pt:
{80a + 72b = 15 g
{a + b = 0,2 mol
=> a=0,075 mol , b=0,125 mol
=> %CuO=\(\dfrac{0,075.80}{15}.100=40\%\)
%FeO=100-40=60%
b, FeO + 2HCl ---> FeCl2 +H2O
0,125 mol 0,25 mol
CuO + 2HCl ---> CuCl2 +H2O
0,075 mol 0,15 mol
=> mct HCl=(0,25+0,15).36,5=14,6 g
=> mdd HCl=14,6:0,3≈48,7 g